题目内容
在25℃时,向100mL含氯化氢14.6g的盐酸溶液中,放入5.6g纯铁粉,反应进行至2 min末收集到氢气1.12L(标准状况),在此之后又经过4min,铁粉完全溶解.若不考虑溶液体积的变化,则:
(1)前2min内用FeCl2表示的平均反应速率是________.
(2)后4min内用HCl表示的平均反应速率是________.
(3)前2min与后4min相比,反应速率________较快,其原因是________.
答案:
解析:
提示:
解析:
|
(1)0.25mol/L·min);(2)0.25mol/(L·min);(3)前者反应速率快,因为随着反应进行,反应物浓度逐渐减小,所以反应速率不断减小 【巧解导析】(1)发生反应:Fe+2HCl (2)由于n(Fe)= (3)前2min内用HCl表示的平均反应速率为v(HCl)=2v(FeCl2)=2×0.25=0.5mol/(L·min),因为0.5>0.25所以前者反应速率快. |
提示:
|
【巧解点悟】解题关键点:将化学反应速率的计算和物质的量应用于化学方程式的计算结合起来.易错点:误将前2min的v(FeCl2)和后4min v(HCl)进行比较而得出错误判断. |

练习册系列答案
相关题目
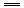 FeCl2+H2↑,前2min内生成FeCl2的物质的量为n(FeCl2)=n(H2),则v(FeCl2)=
FeCl2+H2↑,前2min内生成FeCl2的物质的量为n(FeCl2)=n(H2),则v(FeCl2)=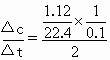 =0.25mol/(L·min).
=0.25mol/(L·min).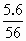 =0.1mol,n(HCl)=
=0.1mol,n(HCl)=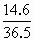 =0.4mol,n(Fe)∶n(HCl)=0.1∶0.4<1∶2,即Fe完全反应,总的消耗盐酸为2×0.1=0.2mol,前2min内耗盐酸2×
=0.4mol,n(Fe)∶n(HCl)=0.1∶0.4<1∶2,即Fe完全反应,总的消耗盐酸为2×0.1=0.2mol,前2min内耗盐酸2×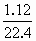 =0.1mol,则后4min内v(HCl)=
=0.1mol,则后4min内v(HCl)=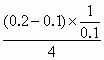 =0.25mol·L-1.
=0.25mol·L-1.