��Ŀ����
����Ŀ��������ĿҪ��ش��������⡣
��1�������£�Ũ�Ⱦ�Ϊ0.lmol��L-1������������Һ��pH���±���
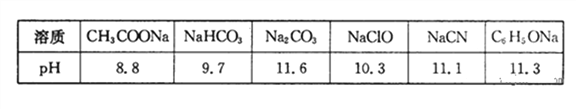
����������Һ�е������ӣ����H+������ǿ����______
�ڸ��ݱ������ݣ�Ũ�Ⱦ�Ϊ0.0lmol��L-1�������������ʵ���Һ�У�������ǿ����______�����ţ���������Һ�ֱ�ϡ��100����pH�仯��С����______�����ţ�
![]()
�۾��ϱ����ݣ������ж����з�Ӧ���ܳ�������______�����ţ�
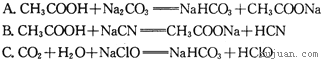
![]()
��2����֪������![]() ����֪������ijCuSO4��Һ��c��Cu2+��=0.02mol��L-1�����Ҫ����Cu��OH��2��������Ӧ������ҺpH����______��
����֪������ijCuSO4��Һ��c��Cu2+��=0.02mol��L-1�����Ҫ����Cu��OH��2��������Ӧ������ҺpH����______��
��3����֪���淴Ӧ![]() ��������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
��������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
 ��д���÷�Ӧƽ�ⳣ���ı���ʽ��______
��д���÷�Ӧƽ�ⳣ���ı���ʽ��______
�����÷�Ӧ������̶����ܱ������н��У���һ�������´ﵽƽ��״̬���ı����������������¶ȣ����������ܶ�______��ѡ�������С�����䡱����
���𰸡� CO32- D C D 5 K= ![]() ��С
��С
����������1���ٸ��ݱ������ݿ�֪̼������Һ�ļ�����ǿ��˵��̼�����ˮ��̶����������ӵ�������ǿ�������H+������ǿ����CO32-������Խ������Ӧ���Խ����ˮ�⣬��˸��ݱ������ݿ�֪�������ǿ����С˳��Ӧ���ǣ�CH3COOH��H2CO3��HClO��HCN��C6H5OH����������ǿ���Ǵ��ᣬ��ѡD��ϡ��ͬ�����������£�����ԽС������pH�仯ԽС����ѡC���۸��ݽ�ǿ���Ʊ��������ԭ����֪ѡ��A��B��C�еķ�Ӧ���ܷ��������ӵ���������̼�ᣬ��ǿ��̼�����ƣ���˱�������̼�ᷴӦ���ɱ��Ӻ�̼�����ƣ���ѡD����2��Ksp[Cu(OH)2]��c(Cu2+)��c2(OH��)����c��Cu2+����0.02mol��L-1ʱ��c(OH��)��1��10-9 mol��L-1����c(H��)��1��10-5mol��L-1������pHҪ����5����3���ٸ�ƽ����FeO��FeΪ���壬Ũ��Ϊһ��ֵ�����ݷ���ʽ��֪�÷�Ӧƽ�ⳣ���ı���ʽΪ![]() �������¶Ⱥ�ƽ�ⳣ��K��ϵ����֪��Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ���淽���ƶ������������ܶȼ�С��
�������¶Ⱥ�ƽ�ⳣ��K��ϵ����֪��Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ���淽���ƶ������������ܶȼ�С��