题目内容
【题目】短周期元素 W、X、Y、Z的原子序数依次增大。W的气态氢化物遇湿润的红色石蕊试纸变蓝色,X是地壳中含量最高的元素,Y在同周期主族元素中原子半径最大,Z 与 Y形成的化合物的化学式为YZ。下列说法不正确的是
A.W 在元素周期表中的位置是第二周期 VA 族
B.同主族中 Z 的气态氢化物稳定性最强
C.X 与 Y 形成的两种常见的化合物中,阳离子和阴离子的个数比均为 2∶1
D.用电子式表示 YZ 的形成过程为:![]()
【答案】B
【解析】
短周期元素 W、X、Y、Z的原子序数依次增大,由W的气态氢化物遇湿润的红色石蕊试纸变蓝色可知,W为N元素;X是地壳中含量最高的元素,则X是O元素,Y在同周期主族元素中原子半径最大,则Y为Na元素,Z 与 Y形成的化合物的化学式为YZ,则Z为Cl元素。
A. W为N元素,位于元素周期表中第二周期 VA 族,故A正确;
B. Z为Cl元素,位于元素周期表中ⅦA族,ⅦA族中F的气态氢化物稳定性最强,故B错误;
C.O与Na可形成氧化钠和过氧化钠两种离子化合物,氧化钠中钠离子和氧离子的个数比为 2∶1,过氧化钠中钠离子和过氧根离子的个数比为 2∶1,故C正确;
D.氯化钠是钠离子和氯离子形成的离子化合物,用电子式表示氯化钠的形成过程为![]() ,故D正确;
,故D正确;
故选B。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
HCN | S8 | SF6 | B12结构单元 | |
结构模型 示意图 |
|
|
|
|
备注 | — | 易溶于CS2 | — | 熔点1 873 K |
A. HCN的结构式为H—C≡N,分子中含有2个σ键和2个π键
B. 固态硫S8属于原子晶体
C. SF6是由极性键构成的非极性分子
D. 单质硼属原子晶体,结构单元中含有30个B—B键
【题目】实验室用少量的溴和足量的乙醇制备1,2一二溴乙烷的装置如图所示:
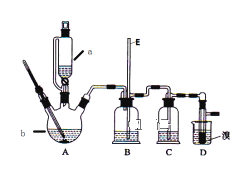
有关数据列表如下:
乙醇 | 1.2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g/cm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
请按要求回答下列问题:
(1)写出A装置中的化学反应方程式_____;
(2)装置C中盛有氢氧化钠溶液,其作用是_____
(3)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____
(4)判断该制备反应已经结束的最简单方法是_____;
(5)若产物中有少量未反应的Br2,最好用_____洗涤除去;(填正确选项前的字母)
a 水 b 亚硫酸氢钠 c 碘化钠溶液 d 乙醇
(6)反应过程中应用冷水冷却装置D,其主要目的是_____;但又不能过度冷却(如用冰水),其原因是_____.


