题目内容
14.为了提纯下列物质(括号内为杂质),除杂试剂和分离方法均正确的是( )| 选项 | 待提纯的物质 | 除杂试剂 | 分离方法 |
| A | 乙醇(乙醇钠) | Na | 过滤 |
| B | 溴苯(Br2) | 苯 | 萃取 |
| C | 苯甲酸(NaCl) | 水 | 重结晶 |
| D | 苯(苯酚) | NaOH溶液 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙醇与Na反应生成乙醇钠;
B.加四氯化碳不分层;
C.苯甲酸的溶解度受温度影响大,NaCl的溶解度受温度影响小;
D.苯酚钠易溶于水,苯难溶于水.
解答 解:A.乙醇与Na反应生成乙醇钠,把主要物质除去了,故A错误;
B.溴苯易溶于苯,加苯不分层,可利用蒸馏法分离,故B错误;
C.苯甲酸的溶解度受温度影响大,NaCl的溶解度受温度影响小,苯甲酸中混有的NaCl可以用重结晶法除去,故C正确;
D.苯酚钠易溶于水,苯难溶于水,苯和苯酚的混合物中加NaOH溶液,振荡、静置会分层,然后分液,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意有机物的性质与实验相结合的应用,题目难度不大.

练习册系列答案
相关题目
4. 已知缬氨酸的结构简式如图,同分异构体中属于氨基酸的有(不考虑立体异构)( )
已知缬氨酸的结构简式如图,同分异构体中属于氨基酸的有(不考虑立体异构)( )
 已知缬氨酸的结构简式如图,同分异构体中属于氨基酸的有(不考虑立体异构)( )
已知缬氨酸的结构简式如图,同分异构体中属于氨基酸的有(不考虑立体异构)( )| A. | 10种 | B. | 11种 | C. | 12种 | D. | 13种 |
5.化学与生活和环境密切相关,下列有关说法中错误的是( )
| A. | 食品包装中常放有硅胶,能起到干燥的作用 | |
| B. | 用工业酒精兑制饮用酒出售来提高利润 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒作用 | |
| D. | 集中处理废旧电池,以防止污染 |
2.下列说法正确的是( )
| A. | 乙烯和聚乙烯都可以与溴水发生加成反应 | |
| B. | 在浓硫酸作催化剂条件下,加热乙醇不一定得到乙烯 | |
| C. | 苯酚在空气中显淡红色,并未变质 | |
| D. | 甲苯最多有15个原子在同一个平面 |
9.下列关于苯的叙述正确的是( )
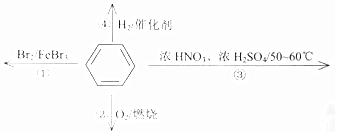

| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰明亮并有大量黑烟 | |
| C. | 反应③为取代反应,控制反应温度在50~60℃的方法是用酒精灯直接加热 | |
| D. | 反应④中1mol苯最多与3molH2发生加成反应,原因是苯分子含有三个碳碳双键 |
19.测定反应A(g)+3B(g)?2C(g)+2D(g)在不同情况下的反应速率,其中的反应速率最快的是( )
| A. | v(A)=0.20 mol/(L•s) | B. | v(B)=0.30 mol/(L•s) | C. | v(C)=0.50 mol/(L•s) | D. | v(D)=0.60 mol/(L•s) |
6.下列有机物的说法,正确的是( )
| A. | 等物质的量的甲烷与氯气反应后体积保持不变 | |
| B. | 石蜡油、苯、环己烷都不能使溴的四氯化碳溶液褪色 | |
| C. | 分子式为C5H12的有机物有三种,它们互为同系物 | |
| D. | C4H8Cl2有8种同分异构体(不考虑立体异构) |
4.煤燃烧产生的SO2是引起酸雨的原因之一.
(1)每隔一定时间测定某处雨水样品的pH值:
雨水样品pH值变小的主要原因是SO2溶于雨水生成H2SO3,H2SO3可被空气中O2缓慢氧化成H2SO4,这样就由弱酸变为了强酸,C(H+)增大,所以pH变小.
(2)反应2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)+Q (Q>0),其化学平衡常数表达式$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$;升高温度,K变小(填“变大”或者“变小”).
(3)判断已达到化学平衡状态的描述是a(选填编号).
a.体系的压强不再发生变化b.2υ正(SO2)=υ逆(O2)
c.c(SO2)=c(SO3)d.气体总质量不再变化
(4)防治酸雨常用的措施:向煤中加石灰,减少 SO2的产生.这种煤燃烧后,大部分硫元素最终转化为固体盐是CaSO4.
(5)把CO2气体通入澄清的石灰水,立即会产生浑浊,但把SO2气体通入澄清的石灰水,却不容易看到浑浊,而CaCO3和CaSO3都是难溶的电解质,试说明原因:SO2在水中的溶解度比CO2大得多,而且H2SO3的酸性比H2CO3强得多,所以通SO2于澄清的石灰水中极易过量,过量后生成Ca(HSO3)2而溶解,不容易看到浑浊.
(6)Na2SO3溶液呈碱性,可吸收尾气SO2.Na2SO3溶液呈碱性的原因(用离子方程式表示)SO32-+H2O?HSO3-+OH-;常温下,0.1mol/L该溶液中离子浓度由大到小排列c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)(用离子符号表示).
(7)常温下,NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有Na2SO3、NaHSO3、NaCl.(用化学式表示).
(1)每隔一定时间测定某处雨水样品的pH值:
| 测定时间 (h) | 0 | 1 | 2 | 4 | 8 |
| 雨水的pH值 | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(2)反应2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)+Q (Q>0),其化学平衡常数表达式$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$;升高温度,K变小(填“变大”或者“变小”).
(3)判断已达到化学平衡状态的描述是a(选填编号).
a.体系的压强不再发生变化b.2υ正(SO2)=υ逆(O2)
c.c(SO2)=c(SO3)d.气体总质量不再变化
(4)防治酸雨常用的措施:向煤中加石灰,减少 SO2的产生.这种煤燃烧后,大部分硫元素最终转化为固体盐是CaSO4.
(5)把CO2气体通入澄清的石灰水,立即会产生浑浊,但把SO2气体通入澄清的石灰水,却不容易看到浑浊,而CaCO3和CaSO3都是难溶的电解质,试说明原因:SO2在水中的溶解度比CO2大得多,而且H2SO3的酸性比H2CO3强得多,所以通SO2于澄清的石灰水中极易过量,过量后生成Ca(HSO3)2而溶解,不容易看到浑浊.
(6)Na2SO3溶液呈碱性,可吸收尾气SO2.Na2SO3溶液呈碱性的原因(用离子方程式表示)SO32-+H2O?HSO3-+OH-;常温下,0.1mol/L该溶液中离子浓度由大到小排列c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)(用离子符号表示).
(7)常温下,NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有Na2SO3、NaHSO3、NaCl.(用化学式表示).
 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空: