题目内容
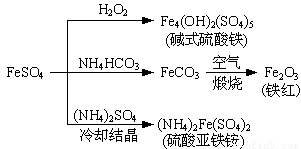
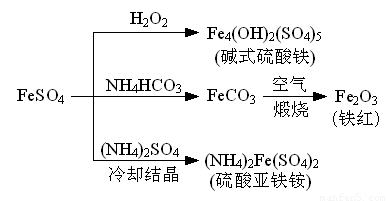
 硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如右图所示).下列说法错误的是
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如右图所示).下列说法错误的是
- A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
- B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
- C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
- D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
D
分析:A.根据Fe3+能发生水解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂;
B.根据NH4HCO3不稳定,受热易分解;
C.KSCN溶液遇Fe2+溶液无现象,遇Fe3+溶液变红;
D.根据溶解度大的沉淀可以转化为溶解度小的沉淀.
解答:A.碱式硫酸铁电离产生Fe3+,Fe3+,能发生水解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂,故A正确;
B.NH4HCO3不稳定,受热易分解,所以为防止NH4HCO3分解,生产FeCO3需在较低温度下进行,故B正确;
C.KSCN溶液遇Fe2+溶液无现象,(NH4)2Fe(SO4)2若被氧化则生成Fe3+,KSCN溶液遇Fe3+溶液变红,故C正确;
D.(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的小,所以FeSO4才能与(NH4)2SO4反应生成(NH4)2Fe(SO4)2,故D错误;
故选D.
点评:本题以硫酸亚铁为原料进行物质的制备,主要考查了物质的性质与反应原理,难度不大.
分析:A.根据Fe3+能发生水解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂;
B.根据NH4HCO3不稳定,受热易分解;
C.KSCN溶液遇Fe2+溶液无现象,遇Fe3+溶液变红;
D.根据溶解度大的沉淀可以转化为溶解度小的沉淀.
解答:A.碱式硫酸铁电离产生Fe3+,Fe3+,能发生水解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂,故A正确;
B.NH4HCO3不稳定,受热易分解,所以为防止NH4HCO3分解,生产FeCO3需在较低温度下进行,故B正确;
C.KSCN溶液遇Fe2+溶液无现象,(NH4)2Fe(SO4)2若被氧化则生成Fe3+,KSCN溶液遇Fe3+溶液变红,故C正确;
D.(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的小,所以FeSO4才能与(NH4)2SO4反应生成(NH4)2Fe(SO4)2,故D错误;
故选D.
点评:本题以硫酸亚铁为原料进行物质的制备,主要考查了物质的性质与反应原理,难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
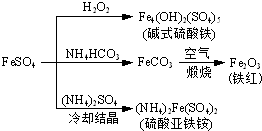 (2013?江苏三模)硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法错误的是( )
(2013?江苏三模)硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法错误的是( )