题目内容
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g)?2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图,根据图回答下列问题:
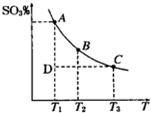
①2SO2(g)+O2(g)?2SO3(g)的△H 0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 .
a.体系的密度不发生变化 b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4mol电子,同时消耗2mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)?2NH3(g).图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.
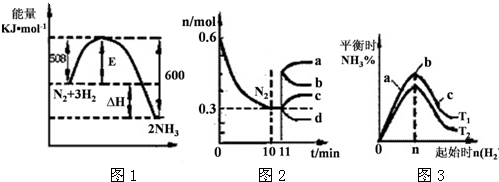
①由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”).
②图3 中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”).
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g?2NO(g)△H>0,若1mol空气含0.8mol N2和0.2mol O2,1300°C时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K= .汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 .
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据: .
(1)硫酸生产过程中2SO2(g)+O2(g)?2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图,根据图回答下列问题:

①2SO2(g)+O2(g)?2SO3(g)的△H
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是
a.体系的密度不发生变化 b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4mol电子,同时消耗2mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)?2NH3(g).图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.

①由图2信息,计算0~10min内该反应的平均速率v(H2)=
②图3 中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g?2NO(g)△H>0,若1mol空气含0.8mol N2和0.2mol O2,1300°C时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据:
考点:体积百分含量随温度、压强变化曲线,化学平衡的影响因素,化学平衡状态的判断
专题:
分析:(1)①曲线上的点都是平衡点,由图可知,温度越高,SO3的百分含量越低,说明升高温度平衡向逆反应移动;
②当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断;
(2)①由图2可知,0~10min内氮气的物质的量变化量为0.6mol-0.3mol=0.3mol,根据v=
计算v(N2),再根据速率之比等于化学计量数之比计算v(H2);11min压缩体积,压强增大,平衡向正反应移动,平衡时氮气的物质的量小于原平衡;
②图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大;由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2;
(3)①平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;该反应正反应为吸热反应,升高温度,反应速率加快,平衡向吸热的方向移动;
②反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行.
②当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断;
(2)①由图2可知,0~10min内氮气的物质的量变化量为0.6mol-0.3mol=0.3mol,根据v=
| △n |
| V |
②图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大;由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2;
(3)①平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;该反应正反应为吸热反应,升高温度,反应速率加快,平衡向吸热的方向移动;
②反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行.
解答:
解:(1)①曲线上的点都是平衡点,由图可知,温度越高,SO3的百分含量越低,说明升高温度平衡向逆反应移动,故该反应正反应是放热反应,△H<0,
故答案为:<;
②a.体积不变的密闭容器中进行反应2SO2(g)+O2(g)?2SO3(g),反应物和生成物都是气体,所以无论是否达平衡,体系的密度不发生变化,故a错误;
b.SO2与SO3的体积比保持不变,SO2与SO3的浓度不再变化,说明正逆反应速率相等,反应达到平衡状态,故b正确;
c.体积不变的密闭容器中,无论是否达平衡,体系中硫元素的质量百分含量始终变化,故c错误;
d.2SO2(g)+O2(g)?2SO3(g),硫元素从+4价升高为+6价,生成2mol三氧化硫,转移4mol电子,所以只要反应开始进行逆反应,单位时间内转移4mol电子,同时消耗2molSO3,不能说明反应达到平衡,故d错误;
e.2SO2(g)+O2(g)?2SO3(g),正反应为气体的分子数减少的反应,当容器内的气体分子总数不再变化,反应达到平衡状态,故e正确;
故答案为:be;
(2)①由图2可知,0~10min内氮气的物质的量变化量为0.6mol-0.3mol=0.3mol,v(N2)=
=0.015mol/(L?min),速率之比等于化学计量数之比,故v(H2)=3v(N2)=3×0.015mol/(L?min)=0.045mol/(L?min),11min压缩体积,压强增大,平衡向正反应移动,平衡时氮气的物质的量小于原平衡,故n(N2)的变化曲线为d,
故答案为:0.045mol/(L?min);d;
②图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,故a、b、c都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大,故a、b、c三点中,c的氮气的转化率最高,量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,
故答案为:c;<;
(3)①假设体积为VL,依据反应的三段式列式计算:N2(g)+O2(g )?2NO(g)
起始量(mol) 0.8 0.2 0
变化量(mol) 4×10-4mol 4×10-4mol 8×10-4mol
平衡量(mol) (0.8-4×10-4)mol (0.2-4×10-4)mol 8×10-4mol
平衡常数K=
=4×10-6,该反应正反应为吸热反应,所以汽车启动后,汽缸温度越高,反应速率加快,平衡右移,
故答案为:4×10-6;温度升高,反应速率加快,平衡右移;
②2CO(g)=2C(s)+O2(g)△H>0 熵减小△S<0,则△H-T△S>0,不能自发进行,故答案为:该反应是焓增,熵减的反应,任何温度下均不能自发进行.
故答案为:<;
②a.体积不变的密闭容器中进行反应2SO2(g)+O2(g)?2SO3(g),反应物和生成物都是气体,所以无论是否达平衡,体系的密度不发生变化,故a错误;
b.SO2与SO3的体积比保持不变,SO2与SO3的浓度不再变化,说明正逆反应速率相等,反应达到平衡状态,故b正确;
c.体积不变的密闭容器中,无论是否达平衡,体系中硫元素的质量百分含量始终变化,故c错误;
d.2SO2(g)+O2(g)?2SO3(g),硫元素从+4价升高为+6价,生成2mol三氧化硫,转移4mol电子,所以只要反应开始进行逆反应,单位时间内转移4mol电子,同时消耗2molSO3,不能说明反应达到平衡,故d错误;
e.2SO2(g)+O2(g)?2SO3(g),正反应为气体的分子数减少的反应,当容器内的气体分子总数不再变化,反应达到平衡状态,故e正确;
故答案为:be;
(2)①由图2可知,0~10min内氮气的物质的量变化量为0.6mol-0.3mol=0.3mol,v(N2)=
| 0.3mol | ||
|
故答案为:0.045mol/(L?min);d;
②图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,故a、b、c都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大,故a、b、c三点中,c的氮气的转化率最高,量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,
故答案为:c;<;
(3)①假设体积为VL,依据反应的三段式列式计算:N2(g)+O2(g )?2NO(g)
起始量(mol) 0.8 0.2 0
变化量(mol) 4×10-4mol 4×10-4mol 8×10-4mol
平衡量(mol) (0.8-4×10-4)mol (0.2-4×10-4)mol 8×10-4mol
平衡常数K=
| c2(NO) |
| c(N2)×c(O2) |
故答案为:4×10-6;温度升高,反应速率加快,平衡右移;
②2CO(g)=2C(s)+O2(g)△H>0 熵减小△S<0,则△H-T△S>0,不能自发进行,故答案为:该反应是焓增,熵减的反应,任何温度下均不能自发进行.
点评:本题考查反应进程与反应热关系图象、化学平衡图象、影响化学平衡的因素、化学平衡常数等,理解三段式求解方法以及外界条件对平衡的影响是解题关键.题目难度较大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
下列离子检验的操作与现象不正确的是( )
| A、向少许待测液中滴加KSCN溶液无明显变化,再滴入氯水,溶液呈红色,则待测液中含有Fe2+ |
| B、向少许待测液中滴几滴稀硝酸,再滴加少许硝酸银,有白色沉淀生成,则待测液中含有Cl- |
| C、向少许待测液中逐滴加入稀氨水至过量,产生白色胶状沉淀,后又逐渐溶解,则待测液中含有Al3+ |
| D、用洁净的铂丝用盐酸清洗后在酒精灯外焰上灼烧至无色时蘸取待测液在外焰上灼烧,透过蓝色钴玻璃观察火焰为紫色,则待测液中含有K+ |
 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.