题目内容
12.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )| A. | X与Y形成化合物时,X显负价,Y显正价 | |
| B. | X的第一电离能一定大于Y | |
| C. | 最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性 | |
| D. | 气态氢化物的稳定性:HnY小于HmX |
分析 X、Y元素同周期,且电负性X>Y,则非金属性X的强,非金属性越强,对应氢化物越稳定、对应最高价含氧酸的酸性越强(F除外),以此来解答.
解答 解:A.电负性X>Y,则X与Y形成化合物时,X显负价,Y显正价,故A正确;
B.若X为O,Y为N,N的2p电子半满为稳定结构,则X的第一电离能小于Y,故B错误;
C.若X为F,不存在最高价含氧酸,X不为F时,最高价含氧酸的酸性为X大于Y,故C错误;
D.非金属性X>Y,气态氢化物的稳定性:HnY小于HmX,故D正确;
故选BC.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素位置与性质关系为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用及元素的特性,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.氯化钾溶液中混有少量的硫酸铜,若加入一种试剂能除去硫酸铜,该试剂为( )
| A. | NaOH | B. | AgNO3 | C. | BaCl2 | D. | Ba(OH)2 |
3.下列说法正确的是( )
| A. | 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应 | |
| B. | 自然界中硅的储量丰富,仅次于氧,自然界中存在大量的单质硅 | |
| C. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl | |
| D. | 从燃煤烟道灰中(含GeO2)提取半导体材料单质锗(Ge),不涉及氧化还原反应 |
20.表为元素周期表前四周期的一部分,下列是有关R、W、X、Y、Z五种元素的叙述,其中正确的是( )
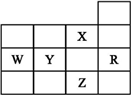

| A. | W元素气态氢化物较Y元素的气态氢化物稳定 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | p能级未成对电子最多的是Z元素 | |
| D. | X元素是非金属性最强的元素 |
7.用括号中的试剂除去各组中的杂质,正确的是( )
| A. | 苯中的甲苯(溴水) | B. | 溴苯中的溴(苯) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 95.6%乙醇中的水(CaO) |
17. 现有mA(s)+nB(g)?pC(g)(正反应放热)的可逆反应,在一定温度下平衡时B的转化率和压强间的关系如图所示,则有关该反应的下列描述中正确的是( )
现有mA(s)+nB(g)?pC(g)(正反应放热)的可逆反应,在一定温度下平衡时B的转化率和压强间的关系如图所示,则有关该反应的下列描述中正确的是( )
 现有mA(s)+nB(g)?pC(g)(正反应放热)的可逆反应,在一定温度下平衡时B的转化率和压强间的关系如图所示,则有关该反应的下列描述中正确的是( )
现有mA(s)+nB(g)?pC(g)(正反应放热)的可逆反应,在一定温度下平衡时B的转化率和压强间的关系如图所示,则有关该反应的下列描述中正确的是( )| A. | m+n<p | B. | n<p | ||
| C. | x点的混合物中v正<v逆 | D. | x点比y点的混合物正反应速度大 |
4.下列说法正确的是( )
| A. | 1 mo1•L-1NaCl溶液中含有1 mol Na+ | |
| B. | 1 mol O2的质量是32 g | |
| C. | 1 mol氢气的体积约为22.4 L | |
| D. | 标准状况下,11.2 L CH4含有10 mol电子 |
1.下列反应适用于实验室制氢气的是:①锌与稀硫酸反应 ②甲烷受热分解 ③电解稀硫酸 ④赤热的炭与水蒸气反应( )
| A. | 只有① | B. | ①② | C. | ①③ | D. | ①②④ |
2.下列说法正确的是( )
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | Na2O由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生 | |
| C. | Na2O2与水反应是水作还原剂的氧化还原反应 | |
| D. | 二氧化碳通过Na2O2粉末,反应后固体物质增重 |