题目内容
14.将KO2放入密闭的真空容器中,一定条件下,发生反应:4KO2(s)?2K2O(s)+3O2(g),达到平衡后,保持温度不变,缩小容器体积,重新达到平衡.下列说法正确的是( )| A. | 容器压强增大 | B. | 氧气浓度不变 | C. | KO2的量保持不变 | D. | 平衡常数增大 |
分析 对于反应4KO2(s)?2K2O(s)+3O2(g),达到平衡后,保持温度不变,缩小容器体积,相当于增大压强,平衡逆向移动,化学平衡常数只与温度有关,据此分析解答.
解答 解:A.缩小容器体积,相当于增大压强,平衡向逆反应方向移动,化学平衡常数=c(O2)3,温度不变,化学平衡常数不变,则氧气浓度不变,所以压强不变,故A错误;
B.化学平衡常数=c(O2)3,温度不变,化学平衡常数不变,则氧气浓度不变,故B正确;
C.平衡向逆反应方向移动,则KO2量增加,故C错误;
D.化学平衡常数只与温度有关,温度不变,平衡常数不变,故D错误;
故选B.
点评 本题考查了可逆反应平衡移动,根据压强与平衡移动方向之间的关系分析解答即可,注意平衡常数只与温度有关,与物质浓度无关,为易错点,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.在水中加入下列物质,可以抑制水电离的是( )
| A. | NaOH | B. | CuCl2 | C. | CH3COONa | D. | KNO3 |
2.配制100mL 1.0mol•L-1Na2CO3溶液,下列操作正确的是( )
| A. | 称取28.6 g Na2CO3•10H2O,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 称取 28.6 g Na2CO3•10H2O,加入100 mL蒸馏水,搅拌、溶解 | |
| C. | 转移时将烧杯中溶液直接倒人容量瓶中 | |
| D. | 定容后,塞好瓶塞,反复倒转、摇匀 |
9.下列变化过程中,属于还原反应的是( )
| A. | HCl→Cl2 | B. | Na→Na+ | C. | CO→CO2 | D. | Fe3+→Fe |
19.ABS合成树脂的结构可表示为 ,则合成该树脂的单体的种类和反应所属类型,正确的是( )
,则合成该树脂的单体的种类和反应所属类型,正确的是( )
 ,则合成该树脂的单体的种类和反应所属类型,正确的是( )
,则合成该树脂的单体的种类和反应所属类型,正确的是( )| A. | 1种,加聚反应 | B. | 2种,缩聚反应 | C. | 3种,加聚反应 | D. | 3种,缩聚反应 |
6.下列有关烷烃的命名错误的是( )
| A. | 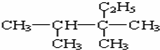 ,3,3-三甲基戊烷 ,3,3-三甲基戊烷 | B. | 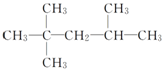 2,2,4三甲基戊烷 2,2,4三甲基戊烷 | ||
| C. | (CH3CH2)2CHCH3 3甲基戊烷 | D. | 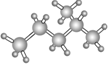 异戊烷 异戊烷 |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol•L-1H2S水溶液中,H2S、HS-和S2-粒子数目之和为0.01NA | |
| B. | 0.16g氨基中含有N-H键的数目为0.02NA | |
| C. | 0.1mol CaO与0.2mol水完全反应后,溶液中Ca2+的数目为0.1NA | |
| D. | 2.24L氯气通入足量的NaOH溶液中,转移的电子数为0.1NA |
19.为了保护环境,充分利用资源.某研究小组通过如图简化流程,将工业制硫酸的硫铁矿烧渣(主要以Fe2O3存在,还含有氧化铝、二氧化硅等杂质)转变成重要的化工原料FeSO4(反应条件略)
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(S04)3+8H2O→15FeSO4+8H2SO4,不考虑其它反应,已知各氢氧化物沉淀PH值,请回答下列问题:
(1)第Ⅲ步目的是调剂PH,去除铝杂质(或除去Al(OH)3\Fe(OH)3).
(2)检验所得绿矾晶体中是否含有Fe3+的实验操作为取少量晶体溶于水,滴加KSCN溶液,若不出现血红色,(或滴加苯酚溶液,不出现紫色)表明不含有Fe3+,反之则含.
(3)得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质,②温度低、用水少降低洗涤过程中硫酸亚铁晶体的损耗.
研究性学习小组对硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究:

(4)装置B的目的是检验产物水生成;装置C中高锰酸钾溶液褪色,使之褪色的物质的名称是二氧化硫;装置D中球形干燥管的作用是防止氢氧化钠溶液倒吸.
(5)硫酸亚铁晶体完全分解后装置A中残留红棕色固体.写出FeSO4分解的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.
(6)设计一个简单实验检验产生的含硫元素的气体: .
.
(7)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量--分解温度的关系如图2,由此得出FeSO4•xH2O中的x值为$\frac{10a-152}{18}$.

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(S04)3+8H2O→15FeSO4+8H2SO4,不考虑其它反应,已知各氢氧化物沉淀PH值,请回答下列问题:
| pH | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 5.8 | 8.8 |
| Fe(OH)3 | 1.1 | 3.2 |
| Al(OH)3 | 3.0 | 5.0 |
(2)检验所得绿矾晶体中是否含有Fe3+的实验操作为取少量晶体溶于水,滴加KSCN溶液,若不出现血红色,(或滴加苯酚溶液,不出现紫色)表明不含有Fe3+,反之则含.
(3)得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质,②温度低、用水少降低洗涤过程中硫酸亚铁晶体的损耗.
研究性学习小组对硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究:

(4)装置B的目的是检验产物水生成;装置C中高锰酸钾溶液褪色,使之褪色的物质的名称是二氧化硫;装置D中球形干燥管的作用是防止氢氧化钠溶液倒吸.
(5)硫酸亚铁晶体完全分解后装置A中残留红棕色固体.写出FeSO4分解的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.
(6)设计一个简单实验检验产生的含硫元素的气体:
 .
.(7)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量--分解温度的关系如图2,由此得出FeSO4•xH2O中的x值为$\frac{10a-152}{18}$.