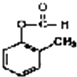
题目内容
【题目】有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,第二份先加热使其完全分解再加足量同质量分数的盐酸,则两者所消耗的盐酸中氯化氢的质量比为( )
A.2:1
B.1:1
C.1:2
D.3:2
【答案】B
【解析】解:第一份中发生反应NaHCO3+HCl═NaCl+H2O+CO2↑,第二份中加热发生反应2NaHCO3 ![]() Na2CO3+H2O+CO2↑,再加入盐酸,发生Na2CO3+2HCl═2NaCl+H2O+CO2↑,两份粉末中发生反应最终都生成氯化钠,令碳酸氢钠的物质的量为1mol,由钠元素守恒可知n(NaHCO3)=n(NaCl)=1mol,根据氯元素守恒可知n(NaCl)=n(HCl)=1mol,故反应后两份粉末中实际消耗的HCl的物质的量之比为1mol:1mol=1:1,质量之比是1:1,
Na2CO3+H2O+CO2↑,再加入盐酸,发生Na2CO3+2HCl═2NaCl+H2O+CO2↑,两份粉末中发生反应最终都生成氯化钠,令碳酸氢钠的物质的量为1mol,由钠元素守恒可知n(NaHCO3)=n(NaCl)=1mol,根据氯元素守恒可知n(NaCl)=n(HCl)=1mol,故反应后两份粉末中实际消耗的HCl的物质的量之比为1mol:1mol=1:1,质量之比是1:1,
故选B.
第一份中发生反应NaHCO3+HCl═NaCl+H2O+CO2↑,第二份中加热发生反应2NaHCO3 ![]() Na2CO3+H2O+CO2↑,再加入盐酸,发生Na2CO3+2HCl═2NaCl+H2O+CO2↑,两份粉末中发生反应最终都生成氯化钠,令碳酸氢钠的物质的量为1mol,结合钠元素、氯元素守恒来解答.
Na2CO3+H2O+CO2↑,再加入盐酸,发生Na2CO3+2HCl═2NaCl+H2O+CO2↑,两份粉末中发生反应最终都生成氯化钠,令碳酸氢钠的物质的量为1mol,结合钠元素、氯元素守恒来解答.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目