题目内容
NA表示阿伏伽德罗常数,下列叙述正确的是
- A.1 mol Cu和足量浓硝酸反应可收集NO2的分子数为2 NA
- B.4℃时,3.6 mL 水所含的电子数为2 NA
- C.30.8 g熟石膏(2CaSO4?H2O)中的钙离子数目为0.20 NA
- D.200 mL 0.5 mol?L-1的Na2CO3溶液中阴离子数目小于0.1 NA
B
分析:A、1 mol Cu和足量浓硝酸反应可生成2molNO2,但是由于NO2和N2O4之间有一个平衡:2NO2?N2O4,所以分子数小于2NA;
B、依据水的密度可知水的质量,可求出水的物质的量,再根据水中电子数计算;
C、依据熟石膏的质量求出其物质的量,再求出Ca2+;
D、由于CO32-要发生水解,其水解方程为:CO32-+H2O?HCO3-+OH-,根据水解方程可知阴离子数目增加.
解答:A、1 mol Cu和足量浓硝酸反应可生成2molNO2,但是由于NO2和N2O4之间有一个平衡:2NO2?N2O4,所以分子数小于2NA,故A错误;
B、依据水的密度可知水的质量m(水)=3.6g,则水的物质的量为n(水)= =
=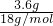 =0.2mol,又因为一个水分子中含有10个电子,故电子的物质的量为2mol,故电子数为2 NA,故B正确;
=0.2mol,又因为一个水分子中含有10个电子,故电子的物质的量为2mol,故电子数为2 NA,故B正确;
C、依据熟石膏的质量求出其物质的量n= =
= =0.106mol,所以n(Ca2+)=0.212,故C错误;
=0.106mol,所以n(Ca2+)=0.212,故C错误;
D、由于CO32-要发生水解,其水解方程为:CO32-+H2O?HCO3-+OH-,根据水解方程可知阴离子数目增加,故阴离子数目大于0.1 NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要是物质中微粒数目的求算,要注意考虑盐类水解;题目难度中等.
分析:A、1 mol Cu和足量浓硝酸反应可生成2molNO2,但是由于NO2和N2O4之间有一个平衡:2NO2?N2O4,所以分子数小于2NA;
B、依据水的密度可知水的质量,可求出水的物质的量,再根据水中电子数计算;
C、依据熟石膏的质量求出其物质的量,再求出Ca2+;
D、由于CO32-要发生水解,其水解方程为:CO32-+H2O?HCO3-+OH-,根据水解方程可知阴离子数目增加.
解答:A、1 mol Cu和足量浓硝酸反应可生成2molNO2,但是由于NO2和N2O4之间有一个平衡:2NO2?N2O4,所以分子数小于2NA,故A错误;
B、依据水的密度可知水的质量m(水)=3.6g,则水的物质的量为n(水)=
 =
=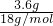 =0.2mol,又因为一个水分子中含有10个电子,故电子的物质的量为2mol,故电子数为2 NA,故B正确;
=0.2mol,又因为一个水分子中含有10个电子,故电子的物质的量为2mol,故电子数为2 NA,故B正确;C、依据熟石膏的质量求出其物质的量n=
 =
= =0.106mol,所以n(Ca2+)=0.212,故C错误;
=0.106mol,所以n(Ca2+)=0.212,故C错误;D、由于CO32-要发生水解,其水解方程为:CO32-+H2O?HCO3-+OH-,根据水解方程可知阴离子数目增加,故阴离子数目大于0.1 NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要是物质中微粒数目的求算,要注意考虑盐类水解;题目难度中等.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目


