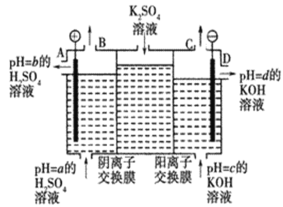
题目内容
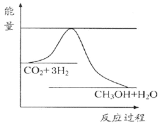
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
(1)该反应平衡常数K的表达式为_________________。
(2)温度降低,平衡常数K_________(填“增大”、“不变”或“减小”)。
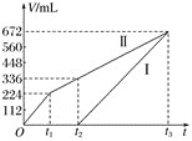
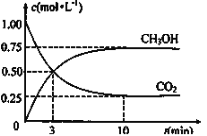
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,CO2和H2的转化率比是________。
(4)下列措施中能使(3)题中![]() 增大的有____________。(填字母)
增大的有____________。(填字母)
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大
E.再充入1mol CO2和3mol H2
【答案】![]() 增大 1:1 CE
增大 1:1 CE
【解析】
(1)该反应平衡常数K的表达式为生成物的浓度幂的乘积与反应物的浓度幂的乘积之比。
(2)由坐标图象可能看出,反应物的总能量大于生成物的总能量,则反应放热。温度降低,平衡正向移动,由此可确定平衡常数K的变化。
(3)先由图中数据求出CO2的浓度变化量为0.75mol/L,利用化学方程式,可求出H2的浓度变化量为2.25mol/L,由此可求出从反应开始到平衡,CO2和H2的转化率比。
(4)A.升高温度,平衡逆向移动,n(CH3OH)减小,n(CO2)增大;
B.加入催化剂,平衡不发生移动;
C.将H2O(g)从体系中分离,平衡正向移动,n(CH3OH)增大,n(CO2)减小;
D.充入He(g),使体系总压强增大,平衡不发生移动;
E.再充入1mol CO2和3mol H2,相当于原平衡体积加压。
(1)平衡常数K为生成物的浓度幂的乘积与反应物的浓度幂的乘积之比,则K=![]() 。答案为:
。答案为:![]() ;
;
(2)由坐标图象可能看出,反应物的总能量大于生成物的总能量,则反应放热。温度降低,平衡正向移动,平衡常数K增大。答案为:增大;
(3)先由图中数据求出CO2的浓度变化量为0.75mol/L,利用化学方程式,可求出H2的浓度变化量为2.25mol/L,由此可求出从反应开始到平衡,CO2和H2的转化率比为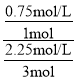 =1:1。答案为:1:1;
=1:1。答案为:1:1;
(4)A.升高温度,平衡逆向移动,n(CH3OH)减小,n(CO2)增大,![]() 比值减小,A不合题意;
比值减小,A不合题意;
B.加入催化剂,平衡不发生移动,B不合题意;
C.将H2O(g)从体系中分离,平衡正向移动,n(CH3OH)增大,n(CO2)减小,![]() 比值增大,C符合题意;
比值增大,C符合题意;
D.充入He(g),使体系总压强增大,平衡不发生移动,D不合题意;
E.再充入1mol CO2和3mol H2,相当于原平衡体积加压,平衡正向移动,n(CH3OH)增大,n(CO2)减小,![]() 比值增大,E符合题意;
比值增大,E符合题意;
故选CE。答案为:CE。