题目内容
水是生命之源,也是化学反应中的主角.请回答下列问题:
Ⅰ、氢气燃烧生成液态水热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol,
(1)生成物能量总和
(2)若2mol氢气完全燃烧生成水蒸气,则放出的热量
(3)氢气热值为
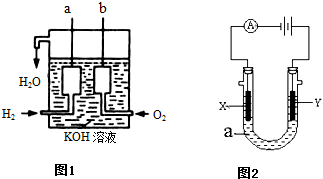
Ⅱ、氢气和氧气反应生成水,将化学能转化为电能,其构造如图1所示:a、b两个电极均由多孔的碳块组成,
(1)a电极反应式是
(2)b电极反应式是
Ⅲ、图2表示一个电解池.X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液.
(1)X极上的电极反应式为
(2)Y极上的电极反应式为
Ⅰ、氢气燃烧生成液态水热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol,
(1)生成物能量总和
小于
小于
(填“大于”、“小于”或“等于”)反应物能量总和.(2)若2mol氢气完全燃烧生成水蒸气,则放出的热量
<
<
572kJ(填“>”、“<”或“=”).(3)氢气热值为
143kJ/g
143kJ/g
.Ⅱ、氢气和氧气反应生成水,将化学能转化为电能,其构造如图1所示:a、b两个电极均由多孔的碳块组成,
(1)a电极反应式是
H2+OH--2e-=2H2O
H2+OH--2e-=2H2O
(2)b电极反应式是
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
Ⅲ、图2表示一个电解池.X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液.
(1)X极上的电极反应式为
2H2O+2e-=H2↑+2OH-
2H2O+2e-=H2↑+2OH-
,在X极附近观察到的现象是产生气泡,溶液变红色
产生气泡,溶液变红色
.(2)Y极上的电极反应式为
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
,检验该电极反应产物的方法是用湿润的淀粉KI试纸检验,试纸变蓝
用湿润的淀粉KI试纸检验,试纸变蓝
.
分析:Ⅰ(1)该反应正反应为放热反应,反应物的总能量大于生成物的总能量;
(2)气态水的能量高于液体水,据此解答;
(3)热值指1kg燃料完全燃烧放出的热量,结合热化学方程式计算;
Ⅱ(1)a极通入氢气,发生氧化反应,在碱性条件下生成水;
(2)b极通入氧气,发生还原反应,生成氢氧根;
Ⅲ(1)X极连接电源的负极,为阴极,发生还原反应,氢离子在X极放电生成氢气,同时生成氢氧根,酚酞遇碱先红色;
(2)Y极连接电源的正极,为阳极,发生氧化反应,氯离子在Y放电生成氯气,用湿润的淀粉KI试纸检验氯气.
(2)气态水的能量高于液体水,据此解答;
(3)热值指1kg燃料完全燃烧放出的热量,结合热化学方程式计算;
Ⅱ(1)a极通入氢气,发生氧化反应,在碱性条件下生成水;
(2)b极通入氧气,发生还原反应,生成氢氧根;
Ⅲ(1)X极连接电源的负极,为阴极,发生还原反应,氢离子在X极放电生成氢气,同时生成氢氧根,酚酞遇碱先红色;
(2)Y极连接电源的正极,为阳极,发生氧化反应,氯离子在Y放电生成氯气,用湿润的淀粉KI试纸检验氯气.
解答:解:Ⅰ(1)该反应正反应为放热反应,生成物的总能量小于反应物总能量,
故答案为:小于;
(2)气态水的能量高于液体水,故生成2mol气态水放出的热量小于572kJ,
故答案为:<;
(3)热值指1kg燃料完全燃烧放出的热量,由热化学方程式可知,1kg氢气燃烧放出的热量为
×572kJ=143000kJ,故氢气的热值为143000kJ/kg=143kJ/g,
故答案为:143kJ/g;
Ⅱ(1)a极通入氢气,发生氧化反应,在碱性条件下生成水,电极反应式为:H2+OH--2e-=2H2O,
故答案为:H2+OH--2e-=2H2O;
(2)b极通入氧气,发生还原反应,生成氢氧根,电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
Ⅲ(1)X极连接电源的负极,为阴极,发生还原反应,氢离子在X极放电生成氢气,同时生成氢氧根,电极反应式为:2H2O+2e-=H2↑+2OH-,溶液呈碱性,故现象为:产生气泡,溶液变红色,
故答案为:2H2O+2e-=H2↑+2OH-;产生气泡,溶液变红色;
(2)Y极连接电源的正极,为阳极,发生氧化反应,氯离子在Y放电生成氯气,电极反应式为:2Cl--2e-=Cl2↑,用湿润的淀粉KI试纸检验,试纸变蓝,
故答案为:2Cl--2e-=Cl2↑;用湿润的淀粉KI试纸检验,试纸变蓝.
故答案为:小于;
(2)气态水的能量高于液体水,故生成2mol气态水放出的热量小于572kJ,
故答案为:<;
(3)热值指1kg燃料完全燃烧放出的热量,由热化学方程式可知,1kg氢气燃烧放出的热量为
| 1000g |
| 4g |
故答案为:143kJ/g;
Ⅱ(1)a极通入氢气,发生氧化反应,在碱性条件下生成水,电极反应式为:H2+OH--2e-=2H2O,
故答案为:H2+OH--2e-=2H2O;
(2)b极通入氧气,发生还原反应,生成氢氧根,电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
Ⅲ(1)X极连接电源的负极,为阴极,发生还原反应,氢离子在X极放电生成氢气,同时生成氢氧根,电极反应式为:2H2O+2e-=H2↑+2OH-,溶液呈碱性,故现象为:产生气泡,溶液变红色,
故答案为:2H2O+2e-=H2↑+2OH-;产生气泡,溶液变红色;
(2)Y极连接电源的正极,为阳极,发生氧化反应,氯离子在Y放电生成氯气,电极反应式为:2Cl--2e-=Cl2↑,用湿润的淀粉KI试纸检验,试纸变蓝,
故答案为:2Cl--2e-=Cl2↑;用湿润的淀粉KI试纸检验,试纸变蓝.
点评:本题考查热化学方程式、原电池、电解池等,难度不大,旨在考查学生对基础知识的理解掌握,注意气体热值通常为kJ/m3.

练习册系列答案
相关题目
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)H2O分子中氧原子采取的是 杂化.写出与H2O分子互为等电子体的微粒 .(写一个即可)
(3)水分子容易得到一个H+形成水合氢离子(H3O+).对上述过程的下列描述不合理的是 .
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.水分子仍保留它的化学性质 D.微粒中的键角发生了改变
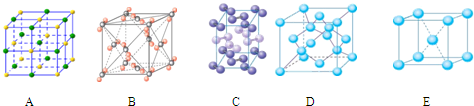
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体
类型相同的是 (请用相应的编号填写)
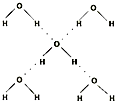
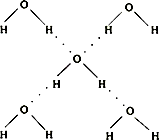
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是 kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式: .
(7)已知下列元素的电负性数据:H:2.1,O:3.5,F:4.0.OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
(8)分析下表数据,请写出你的最具概括性的结论:
① ;② .
(1)水分子中氧原子在基态时核外电子排布式为
(2)H2O分子中氧原子采取的是
(3)水分子容易得到一个H+形成水合氢离子(H3O+).对上述过程的下列描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.水分子仍保留它的化学性质 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体
类型相同的是


(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式:
(7)已知下列元素的电负性数据:H:2.1,O:3.5,F:4.0.OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
(8)分析下表数据,请写出你的最具概括性的结论:
| 键型 | 键能 (kJ/mol) |
键长 (pm) |
分子 | 键角 | 物质 | 熔点(℃) | 沸点(℃) |
| H-C | 413 | 109 | 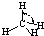 |
109.5° | 甲烷 | -183.7 | -128.0 |
| H-N | 391 | 101 | 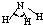 |
107° | 氨 | -77.7 | -33.3 |
| H-O | 467 | 96 | 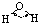 |
104.5° | 水 | 0.0 | 100.0 |
水是生命之源,也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为___ _______;
(2)H2O分子中氧原子采取的是 杂化。
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是 。
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.水合氢离子分子构型是三角锥型 | D.微粒中的键角发生了改变 |
水是生命之源,也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为 。
(2)H2O分子中氧原子采取的是 杂化。
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的空间构型发生了改变
C.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______。(请用相应的编号填写)
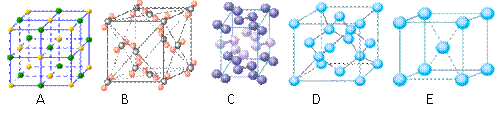 |

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol。
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。