题目内容
10.Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示.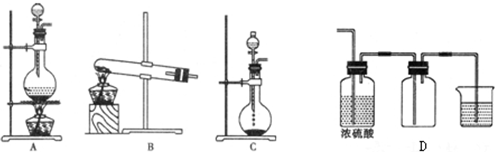
(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气,化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)气体的性质是选择气体收集方法的主要依据,下列性质与收集方法无关的是(填序号,下同)②④.
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X气体可以是下列气体中的③.
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中D装置中连接小烧杯的目的是尾气处理防止污染.
Ⅱ.某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成橙黄色晶体X.为确定其组成,进行如下实验.
(4)经测定,样品X中钴、氨、氯的物质的量之比为1:6:3,钴的化合价为+3.
已知X的化学式类似于下列化学式:
氢氧化二氨合银Ag(NH3)2OH、硫酸四氨合铜[Cu(NH3)4]SO4
制备X的化学方程式2CoCl2+2NH4Cl+10NH3+H2O2$\frac{\underline{\;催化剂\;}}{\;}$2[Co(NH3)6]Cl3+2H2O.
(5)氨的测定:精确称取wgX,加适量水溶解,注入如下图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mL c1mol•L-1的盐酸标准溶液吸收,蒸氨结束后取下接收瓶,用c2mol•L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mL NaOH溶液.
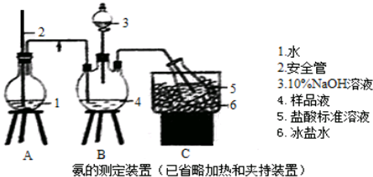
①5(装盐酸标准液)的仪器名称酸式滴定管.
②装置中安全管的作用原理当A中压力过大,安全管中液面升高,使A瓶压力稳定.
③样品中氨的质量分数表达式$\frac{(C{\;}_{1}{V}_{1}-{C}_{2}{V}_{2})×1{0}^{-3}mol×17g/mol}{W}$×100%.
分析 (1)实验室用加热氯化铵与氢氧化钙的方法制取氯气;
(2)收集气体依据气体的密度与溶解度选择排气法或者排液法;
(3)AD相连制取的气体特点:固体与液体加热,不能与浓硫酸反应,密度大于空气密度;D为尾气处理装置,防止污染空气;
(4)样品X中钴、氨和氯的物质的量之比为1:6:3,则其化学式为[Co(NH3)6]Cl3,根据化合物中各元素化合价的代数和为0计算Co元素化合价;
该反应中Co失电子、双氧水得电子,CoCl2•6H2O、NH4Cl、H2O2、NH3发生反应生成[Co(NH3)6]Cl3和水;
(5)①酸性溶液只能盛放在酸式滴定管中;
②通过2中液面调节A中压强;
③根据氨气与和盐酸反应之间的关系式计算氨气的质量,再根据质量分数公式计算氨质量分数.
解答 解:(1)氯化铵与氢氧化钙加热生成氨气、氯化钙和水,方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
(2)收集气体依据气体的密度以及能否与空气反应、溶解度选择排气法或者排液法,与气体颜色、热稳定性无关;
故选:②④;
(3)AD相连制取的气体特点:固体与液体加热,不能与浓硫酸反应,密度大于空气密度、能溶于水,D为尾气处理装置,防止污染空气;
①制取CO2不需加热,故不选;
②NO 能够与氧气反应,不能用排气法收集,故不选;
③制取Cl2 用浓盐酸与二氧化锰加热制取,其密度大于空气密度,用向上排气法收集,能用浓硫酸干燥,溶于水,故选;
④制备H2 不需加热,且氢气密度小于空气密度,收集应短进长出,故不选;
⑤HCl极易溶于水,尾气直接插入水中会发生倒吸,故不选;
故选:③;D为尾气处理装置,防止污染空气;
(4)样品X中钴、氨和氯的物质的量之比为1:6:3,则其化学式为[Co(NH3)6]Cl3,根据化合物中各元素化合价的代数和为0得Co元素化合价为+3价;该反应中Co失电子、双氧水得电子,CoCl2•6H2O、NH4Cl、H2O2、NH3发生反应生成[Co(NH3)6]Cl3和水,反应方程式为2CoCl2+2NH4Cl+10NH3+H2O2$\frac{\underline{\;催化剂\;}}{\;}$2[Co(NH3)6]Cl3+2H2O,
故答案为:+3;2CoCl2+2NH4Cl+10NH3+H2O2$\frac{\underline{\;催化剂\;}}{\;}$2[Co(NH3)6]Cl3+2H2O;
(5)①酸性溶液只能盛放在酸式滴定管中,所以盛标准溶液盐酸的仪器为酸式滴定管,
故答案为:酸式滴定管;
②无论三颈瓶中压强过大或过小,都不会造成危险,若过大,A在导管内液面升高,将缓冲压力,若过小,外界空气通过导管进入烧瓶,也不会造成倒吸,安全作用的原理是使A中压强稳定;
故答案为:当A中压力过大,安全管中液面升高,使A瓶压力稳定;
③与氨气反应的n(HCl)=V1×10-3L×C1mol•L-1-C2mol•L-1 ×V2×10-3L=(C1V1-C2V2)×10-3mol,根据氨气和HCl的关系式知,n(NH3)=n(HCl)=(C1V1-C2V2)×10-3mol,氨的质量分数=$\frac{(C{\;}_{1}{V}_{1}-{C}_{2}{V}_{2})×1{0}^{-3}mol×17g/mol}{W}$×100%;
故答案为:$\frac{(C{\;}_{1}{V}_{1}-{C}_{2}{V}_{2})×1{0}^{-3}mol×17g/mol}{W}$×100%.
点评 本题为综合题,考查了常见气体制备原理和装置选择的原则,物质含量的测定,熟悉气体制备原理及气体的性质是解题关键,题目难度中等.

| A. |  干燥Cl2 干燥Cl2 | B. |  吸收HCl | C. |  稀释浓H2SO4 | D. |  制取Fe(OH)2沉淀 |
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z的氢化物反应 |
| A. | 淀粉中加碘水后变蓝 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 蛋白质水解能得到氨基酸 | |
| D. | 淀粉和纤维素互为同分异构体 |
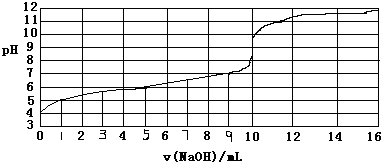
| A. | 此实验可以选用酚酞作指示剂 | |
| B. | 弱酸HA的浓度约为1×10-4mol/L | |
| C. | 根据已知条件,弱酸HA的电离常数(Ka)不能计算 | |
| D. | 当NaOH体积为9ml时,恰好完全中和反应 |
| A. | 乙烯聚合为聚乙烯高分子材料 | B. | 由苯制硝基苯 | ||
| C. | 以铜和浓硝酸为原料生产硝酸铜 | D. | 用SiO2制备高纯硅 |
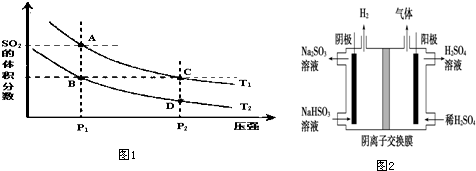
(1)比较K值的大小,K1<K2(填>、=、<).
(2)下列说法正确的是CD
A.A、C两点的正反应速率:A>C
B.A、C两点SO2气体的浓度:A>C
C.B、C两点的气体的平均相对分子质量:B=C
D.由状态D到状态C,可以用加热的方法
(3)在500℃时,若保持容积不变,每隔一定时间就对该容器内的物质进行分析,得到如下表的部分数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(SO2)/mol | 2.00 | 0.60 | |||
| n(SO3)/mol | 0.00 | 0.80 | 1.8 | 1.8 |
②该条件下反应的平衡常数K的值为368.2(精确到小数点后一位).
(4)工业上用Na2SO3吸收尾气中的SO2使之转化为NaHSO3,再用图2装置电解(惰性电极)NaHSO3制取H2SO4,该电解池阴极的总电极反应式2HSO3-+2e-═SO32-+H2↑,阳极室除生成硫酸外,还有少量的SO2 和O2生成.则阳极发生的副反应的电极反应式为2SO32-+4e-═2SO2↑+O2↑,该工艺中可循环利用的物质是Na2SO3、H2SO4、SO2(填化学式).
| A. | 可能含有Ag+、Al3+、NH4+ | B. | 一定不含Cl-,可能含有NO3- | ||
| C. | 一定不含NH4+、AlO2-、CO32- | D. | 可能含有Fe3+,一定不含Fe2+ |
 溴苯是一种化工原料,实验室合成溴苯及检验溴与苯发生了取代反应的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯及检验溴与苯发生了取代反应的装置示意图及有关数据如下: