题目内容
15.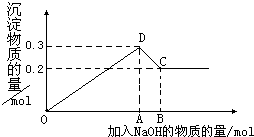 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:(1)写出代表各线段发生反应的离子方程式:
OD段Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,
CD段:Al(OH)3+OH-═AlO2-+2H2O,
(2)原溶液中Mg2+、Al3+物质的量浓度之比为2:1.
(3)图中C点表示当加入0.8mol NaOH时,Al3+已经转变为AlO2-,Mg2+已经转变为Mg(OH)2.
(4)图中线段OA:AB=7:1.
分析 (1)生的离子反应有:0~D段Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓、C~D段Al(OH)3+OH-═AlO2-+2H2O;
(2)C点对应的沉淀为Mg(OH)2,D点对应的沉淀为Mg(OH)2和Al(OH)3,则Mg(OH)2的物质的量为0.2mol,Al(OH)3的物质的量为:0.3mol-0.2mol=0.1mol,由Mg(OH)2~Mg2+、Al(OH)3~Al3+,溶液的体积相同,浓度之比等于物质的量之比;
(3)由Mg2++2OH-═Mg(OH)2↓
0.2mol 0.4mol
Al3++3OH-═Al(OH)3↓
0.1mol 0.3mol
Al(OH)3+OH-═AlO2-+2H2O
0.1mol 0.1mol
据此计算C点NaOH的物质的量及铝离子、镁离子的存在形式;
(4)0~D发生Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,D~C发生Al(OH)3+OH-═AlO2-+2H2O,则线段OA对应的NaOH的物质的量为0.4mol+0.3mol=0.7mol,线段AB对应的NaOH的物质的量为0.1mol,据此计算线段OA:AB.
解答 解:(1)由图象可知,0~D发生反应为:Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,C~D发生反应为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓;Al(OH)3+OH-═AlO2-+2H2O;
(2)C点对应的沉淀为Mg(OH)2,D点对应的沉淀为Mg(OH)2和Al(OH)3,
则Mg(OH)2的物质的量为0.2mol,Al(OH)3的物质的量为:0.3mol-0.2mol=0.1mol,
由Mg(OH)2~Mg2+、Al(OH)3~Al3+,溶液的体积相同,浓度之比等于物质的量之比,
所以原溶液中Mg2+、Al3+物质的量浓度之比为0.2mol:0.1mol=2:1,
故答案为:2:1;
(3)由Mg2++2OH-═Mg(OH)2↓
0.2mol 0.4mol
Al3++3OH-═Al(OH)3↓
0.1mol 0.3mol
Al(OH)3+OH-═AlO2-+2H2O
0.1mol 0.1mol
则C点NaOH的物质的量为0.4mol+0.3mol+0.1mol=0.8mol,此时铝离子完全转化为AlO2-,镁离子完全转化为沉淀,
故答案为:0.8;AlO2-;Mg(OH)2;
(4)0~D发生Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,
D~C发生Al(OH)3+OH-═AlO2-+2H2O,
则线段OA对应的NaOH的物质的量为0.4mol+0.3mol=0.7mol,
线段AB对应的NaOH的物质的量为0.1mol,
所以线段OA:AB=0.7mol:0.1mol=7:1,
故答案为:7:1.
点评 本题考查学生利用离子反应及金属与金属的化合物的性质来计算,题目难度中等,明确图象中每段发生的化学反应是解答本题的关键,并注意利用原子守恒的方法来解答.

 阅读快车系列答案
阅读快车系列答案| A. | 乙醇与丙三醇 | B. | C6H5OH与C6H5CH2OH | ||
| C. | 重氢与超重氢 | D. | 新戊烷与正丁烷 |
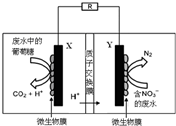
| A. | 电池工作时,既能净化废水,又能发电 | |
| B. | X电极为负极,工作时发生氧化反应 | |
| C. | 正极反应式为2NO3-+10e-+6H2O═N2↑+12OH- | |
| D. | 该电池在常温和高温时都可以工作 |
①加盐酸溶解
②加过量烧碱溶液溶解
③过滤
④通入过量CO2生成Al(0H)3沉淀
⑤加入盐酸,生成Al(0H)3沉淀
⑥加入过量氨水溶液,生成Al(0H)3沉淀.
| A. | ①③⑥③ | B. | ②③⑥③ | C. | ②③④③ | D. | ②③⑤③ |
| A. | 属于置换反应 | B. | H-是氧化剂 | ||
| C. | NH3是还原剂 | D. | 氧化产物和还原产物都是H2 |
| A. | 已知P(红磷,s)=P(白磷,s)△H>0,则白磷比红磷稳定 | |
| B. | 测定相同物质的量浓度的Na2CO3、Na2SiO3的溶液pH,发现后者的更高,说明碳的非金属性强于硅 | |
| C. | 温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态. | |
| D. | 将NaAlO2溶液与NaHCO3溶液混合后生成白色沉淀,是两种溶液水解相互促进的结果 |
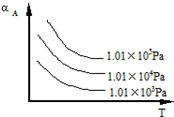 在一密闭容器中加入A、B进行可逆反应:A(g)+B(g)?m C(g)(m为整数),A的转化率(αA)与温度(T)、压强的关系如图所示:
在一密闭容器中加入A、B进行可逆反应:A(g)+B(g)?m C(g)(m为整数),A的转化率(αA)与温度(T)、压强的关系如图所示: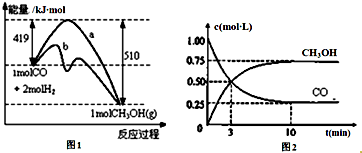 工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.请回答下列问题:
工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.请回答下列问题: