题目内容
【题目】教材插图具有简洁而又内涵丰富的特点。请回答以下问题 :
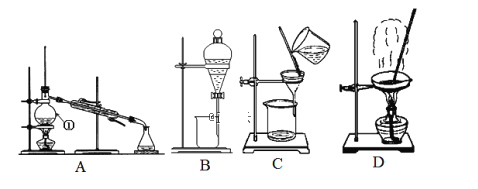
(1) 第三周期的某主族元素.其第一至第五电离能数据如图1所示.则该元素对应的原子有___________种不问运动状态的电子。
(2)如图2所示.每条折线表示周期表IVA–VIIA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是________。判断依据是__________。
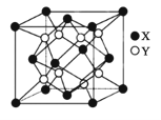
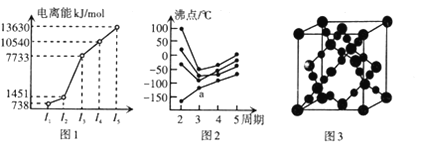
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该CO2晶体属于_____晶体。
(4) 第一电离能介于Al、P之间的第三周期元素有_____ 种。CaCl3中Ca原子的杂化力式为_______,写出一种与CaCl3且为电子体的离子的化学式_________ 。
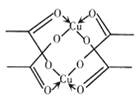
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性.而干冰、碘的晶体具有相似的结构特征 ,干冰晶体中一个分子周围有______个紧邻分子。醋酸铜晶体局部结构如右图,该晶体中含有的化学键是____________(填字母标号)。
a 极性键 b非极性键 c 配位键 d. 金属键
(6) Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图示中正确的是_____ (填字母标号)。
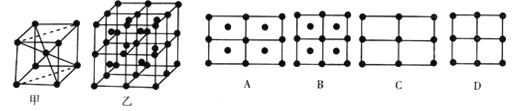
铁原子的配位数是__________,假设铁原于的半径是r cm.,该晶体的密度是ρg/cm3 则铁的相对原子质量为______________ (设阿伏加德罗常数的值为NA) 。
【答案】12 SiH4 在IVA~VIIA的氢化物中.只有IVA族元素氢化物沸点不存在反常现象,且a为第三周期氢化物 ,故 a 为SiH4 原子 3 sp2杂化 CO32- 12 abc A 8 ![]()
【解析】
(1)图1中,I2 与I3相差较大,该元素原子最外层有两个电子,应是第三周期主族元素镁(Mg),电子的运动状态取决于电子所处的能层、能级、原子轨道和自旋方向,镁原子核外共有12个电子,则有12种不同运动状态的电子,故答案为:12;
(2)第ⅣA ~ⅦA元素的氢化物中,NH3、H2O、HF的分子间有氢键,使得它们的沸点与同族其它元素的氢化物相比“反常”,图2中a点所在折线无“反常”,为第IVA元素的氢化物,a点代表的是第三周期的氢化物SiH4,故答案为:SiH4;在IVA~VIIA的氢化物中只有IVA族元素氢化物沸点不存在反常现象,且a为第三周期氢化物;
(3)图3中,C、O原子通过共价键形成空间网状晶体,属于原子晶体,故答案为:原子;
(4)第IIA族元素np能级全空、第VA族元素np能级半充满,使第一电离能出现“反常”,第三周期元素第一电离能由小到大的顺序为Na、Al、Mg、Si、S、P、Cl、Ar,介于Al、P之间的有Mg、Si、S三种元素,Ga位于第四周期第IIIA族,GaCl3分子中,Ga原子价层电子对数为(3+1×3)/2=3,则其杂化方式为sp2,写与GaCl3互为等电子体的离子,可在价电子总数不变的前提下,将Ga、Cl换成它们的邻族元素,如CO32-等,故答案为:3;sp2杂化;CO32-;
(5)干冰晶胞为面心立方堆积,若考察上表面的面心二氧化碳分子,则它与上表面的四个顶点、前后左右四个面心、以及上面一个晶胞的前后左右四个面心,共12个二氧化碳分子距离最近且相等。从D的醋酸盐晶体局部结构看,该晶体中有C-H、C-O、C=O、O-D等极性键,有C-C非极性键,有O→D配位键,故答案为:abc;
(6)图甲为该铁的一个晶胞,沿虚线的切面为长方形,长是宽的![]() 倍,四个顶角和中心有铁原子。图乙为8个晶胞叠成的立方体,沿虚线的切面为A图,考察图甲体心铁原子,则其配位数为8,设图甲中晶胞边长为a cm,则体对角线为
倍,四个顶角和中心有铁原子。图乙为8个晶胞叠成的立方体,沿虚线的切面为A图,考察图甲体心铁原子,则其配位数为8,设图甲中晶胞边长为a cm,则体对角线为![]() a cm。又体对角线上三原子相切,得
a cm。又体对角线上三原子相切,得![]() a cm=4r cm。根据密度和铁原子数求得的一个晶胞质量相等,有ρg/cm3×(a cm)3=
a cm=4r cm。根据密度和铁原子数求得的一个晶胞质量相等,有ρg/cm3×(a cm)3=![]() ,解得M(Fe)=
,解得M(Fe)=![]() g/mol,Mr(Fe)=
g/mol,Mr(Fe)=![]() ,故答案为:A;8;
,故答案为:A;8;![]() 。
。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
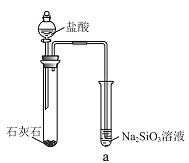
黄冈经典趣味课堂系列答案【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:下列结论不正确的是( )
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
A.Na2SiO3溶液一定显碱性
B.由Ⅰ能说明酸性H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时Na2CO3溶液的碱性强于NaHCO3溶液
D.向Na2SiO3溶液中通入少量CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓