题目内容
7.下列溶液中粒子浓度的关系正确的是( )| A. | 0.1 mol•L-1 Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 0.1 mol•L-1 CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH) | |
| C. | pH相同的①CH3COONa②NaHCO3两份溶液中的c(Na+):①<② | |
| D. | 用NaOH溶液滴定CH3COOH溶液至pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
分析 A.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
B.任何电解质溶液中都存在物料守恒和电荷守恒,根据物料守恒和电荷守恒判断;
C.pH相等的这两种钠盐,弱酸根离子水解程度越大其钠盐浓度越小,则钠离子浓度越小,弱酸根离子水解程度与其对应的弱酸酸性成反比;
D.中性溶液中c(OH-)=c(H+),结合电荷守恒判断.
解答 解:A.任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)],故A错误;
B.任何电解质溶液中都存在物料守恒和电荷守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=c(Na+),
根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),
所以得c(OH-)=c(H+)+c(CH3COOH),故B正确;
C.pH相等的这两种钠盐,弱酸根离子水解程度越大其钠盐浓度越小,则钠离子浓度越小,弱酸根离子水解程度与其对应的弱酸酸性成反比,酸性CH3COOH>H2CO3,所以生成程度HCO3->CH3COO-,则钠盐浓度①>②,c(Na+):①>②,故C错误;
D.中性溶液中c(OH-)=c(H+),结合电荷守恒得c(Na+)=c(CH3COO-),盐类水解程度、弱电解质电离程度都较小,所以存在c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,注意电荷守恒和物料守恒的应用,易错选项是C,知道弱酸酸性强弱与其钠盐水解程度关系,注意:HCO3-对应的酸是H2CO3、CO32-对应的酸是HCO3-,为易错点.

练习册系列答案
相关题目
17.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 10mL 18mol/L浓硫酸与足量铜加热充分反应,其中有0.09NA个H2SO4体现了氧化性 | |
| B. | 将5.6g铁在3.36LCl2中点燃,二者一定能恰好完全反应 | |
| C. | 100mL 1mol/L硫酸溶液中,有0.1mol H2SO4分子 | |
| D. | 标准状况下,22.4 L CO2和CO混合气体中含有的碳原子数约为NA |
18.现有三种液态混合物:①乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃);②汽油和水③溴水.在实验室分离这三种混合物的正确方法依次为( )
| A. | 蒸馏、分液、萃取 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
15.下列说法正确的是( )
| A. | 16O2和17O2都是氧的同素异形体 | |
| B. | 金属氧化物都是碱性氧化物 | |
| C. | 烟和雾可发生丁达尔现象,都属于胶体 | |
| D. | 合成纤维和光导纤维都是无机非金属材料 |
2.Mg SO2 H2SO4 NaOH NaCl的顺序是按某一分类规律排列的.下列物质的排序符合此分类规律的是( )
| A. | Na2CO3 C CO2 Ca(OH)2 HNO3 | B. | Na3PO4 Na SO2 H2SO3 KOH | ||
| C. | Si CO2 H3PO4 Ba(OH)2 Na2S | D. | N2 NO HNO3 NH3 NaBr |
12.下列说法正确的是( )
| A. | 5.6g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023 | |
| B. | 反应MgCl2(l)=Mg(l)+Cl2(g)的△H<0、△S>0,故任何温度下都能自发进行 | |
| C. | 电解精炼铜过程中,电路中每通过1mol电子,阳极溶解铜32g | |
| D. | 0.1mol/LNa2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HSO3-) |
16.镁-空气电池的工作原理如图所示.下列说法不正确的是( )
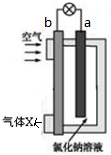

| A. | 工作一段时间后,c(Na+)变大 | |
| B. | 电池工作时,OH-向a极移动 | |
| C. | 气体X 中N2的百分含量与空气相同 | |
| D. | 电池总反应为2Mg+O2+2H2O═2 Mg(OH)2 |
17.下列反应属于吸热反应的是( )
| A. | 酸碱中和反应 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |
 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).