题目内容
20.将CaCl2•nH2O的晶体2.19克溶于水,配成100mL溶液,与20克17%的AgNO3溶液反应,使氯离子刚好完全沉淀.求:CaCl2•nH2O的式量及n值是多少?
分析 n(AgNO3)=$\frac{20g×17%}{170g/mol}$=0.02mol,氯化钙和硝酸银反应化学方程式为CaCl2+2AgNO3=2AgCl↓+Ca(NO3)2,根据方程式知,要使氯离子恰好完全沉淀,说明n(CaCl2)=$\frac{1}{2}$n(AgNO3)=$\frac{1}{2}$×0.02mol=0.01mol,根据M=$\frac{m}{n}$计算其摩尔质量,相对分子质量与其摩尔质量在数值上相等,从而确定n.
解答 解:n(AgNO3)=$\frac{20g×17%}{170g/mol}$=0.02mol,氯化钙和硝酸银反应化学方程式为 CaCl2+2AgNO3=2AgCl↓+Ca(NO3)2,根据方程式知,要使氯离子恰好完全沉淀,说明n(CaCl2)=$\frac{1}{2}$n(AgNO3)=$\frac{1}{2}$×0.02mol=0.01mol,M(CaCl2•nH2O)=$\frac{m}{n}$=$\frac{2.19g}{0.01mol}$=219g/mol,相对分子质量在数值上等于其摩尔质量,所以CaCl2•nH2O的式量219;n=$\frac{219-111}{18}$=6,
答:CaCl2•nH2O的式量是219,n为6.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,明确氯化钙和硝酸银物质的量关系是解本题关键,题目难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
10.下列说法错误的是( )
| A. | 使用分液漏斗、容量瓶前都应先检漏 | |
| B. | 用托盘天平可以称取25.12g NaCl固体 | |
| C. | 仰视量筒刻度线量取浓硫酸配成的稀硫酸浓度偏高 | |
| D. | 不用任何试剂可以鉴别开NaOH、MgSO4、Ba(NO3)2、Cu(NO3)2、KNO3 五种溶液 |
11.下列说法正确的是( )
| A. | HOCH2COOH既可以发生取代反应又可以发生缩聚反应 | |
| B. | 蔗糖、纤维素的水解过程都是高分子转化为小分子的过程 | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| D. | 按系统命名法,化合物 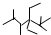 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 |
12.常温下,将某可溶性一元碱X0H和盐酸等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明XOH是强碱还是弱碱a=7为强碱,a<7为弱碱.
(2)考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2否(选填“是”或“否”).混合液中离子浓度c(Cl-)与 c(X+)的大小关系是c(Cl-)=c(X+).
(3)丙组实验结果分析,XOH是弱碱(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是
(Cl-)>c(X+)>c(H+)>c(OH-).
(4)若甲组实验中a=5,则该混合溶液中:
c(Cl-)-c(X+)=10-5-10-9mol•L-1; c(H+)-c(XOH)=10-9mol•L-1.
| 实验编号 | XOH物质的量浓度(mol•L-1) | 盐酸物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
(2)考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2否(选填“是”或“否”).混合液中离子浓度c(Cl-)与 c(X+)的大小关系是c(Cl-)=c(X+).
(3)丙组实验结果分析,XOH是弱碱(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是
(Cl-)>c(X+)>c(H+)>c(OH-).
(4)若甲组实验中a=5,则该混合溶液中:
c(Cl-)-c(X+)=10-5-10-9mol•L-1; c(H+)-c(XOH)=10-9mol•L-1.
16.下列现象不能用胶体的性质解释的是( )
①用氯气对自来水消毒 ②用石膏或盐卤点制豆腐 ③清晨的阳光穿过茂密的林木枝叶产生美丽的光圈 ④在NaCl溶液中滴入AgNO3溶液产生沉淀 ⑤长江水在入海口形成三角洲.
①用氯气对自来水消毒 ②用石膏或盐卤点制豆腐 ③清晨的阳光穿过茂密的林木枝叶产生美丽的光圈 ④在NaCl溶液中滴入AgNO3溶液产生沉淀 ⑤长江水在入海口形成三角洲.
| A. | ①② | B. | ②③⑤ | C. | ①④ | D. | 只有④ |
17.下列实验可行的是( )
| A. | 苯、CCl4、酒精可用来萃取溴水中的溴 | |
| B. | 用激光笔鉴别Fe(OH)3胶体和FeCl3溶液 | |
| C. | 加入盐酸以除去硫酸钠中的少量碳酸钠杂质 | |
| D. | 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 |