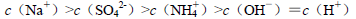题目内容
氢气既是最理想的能源又是重要的化工原料,用甲烷制氢气是一种廉价的制氢方法。有关的热化学方程式如下:
①CH4(g)+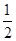 O2(g)
O2(g) CO(g)+2H2(g) ΔH<0
CO(g)+2H2(g) ΔH<0
②CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
下列说法不正确的是( )
| A.当反应①中v(CH4)正=v(CO)逆时,表明该反应达平衡状态 |
| B.其他条件不变时,增大体系压强,反应①、②中甲烷的转化率均减小 |
| C.使用高效催化剂可以加快反应速率,同时提高CH4的转化率 |
| D.同一容器内同时发生反应①与②时,容器内温度可能保持不变 |
C
解析

N2 (g)+3H2 (g)  2NH3(g) ΔH=-92.4 kJ·mol-1。 1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) ΔH=-92.4 kJ·mol-1。 1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示。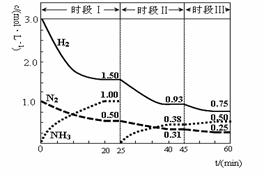
下列说法错误的是:
| A.前20分钟反应物的转化率为50% |
| B.第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C.时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数增大 |
| D.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |
某温度下在密闭容器中发生如下反应:2SO2(g)+O2(g) 2SO3(g),若开始时只充入2 molSO3,达到平衡时,混合气体的压强比起始时增大了10%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为:
2SO3(g),若开始时只充入2 molSO3,达到平衡时,混合气体的压强比起始时增大了10%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为:
| A.10% | B.60% | C.80% | D.90% |
将2mol H2和1mol CO2充入体积为10L的恒容密闭容器中,在一定条件下发生反应:
①CO2(g)+ H2(g) CO(g) + H2O(g) △H1=+41.2kJ·moL-1;
CO(g) + H2O(g) △H1=+41.2kJ·moL-1;
②CO2(g)+ 3H2(g) CH3OH(g) + H2O(g) △H2=-49kJ·moL-1。
CH3OH(g) + H2O(g) △H2=-49kJ·moL-1。
反应100min后达到平衡,测得下表数据:
| 温度 | 转化率(%) | 物质的量(mol) | ||
| H2 | CO2 | CH3OH | CO | |
| 240℃ | | 10 | 0.05 | 0.05 |
下列说法正确的是
A.升高温度,反应①的平衡常数减小
B.升高温度,CH3OH的含量提高
C.H2转化率为10%
D.100min内,反应②的速率为v(CO2)=0.0001 mol·L-1·min-1
在其它条件不变时,10℃时以某物质表示的反应速率为3 mol?(L· s )-1,已知温度每升高10℃反应速率是原来的2倍,则温度为50℃时,该反应的速率为
| A.48 mol?(L· s )-1 | B.36 mol?(L· s )-1 |
| C.24 mol?(L· s )-1 | D.12 mol?(L· s )-1 |
700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
下列说法正确的是( )
A.反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)="0.40" mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
下列有关说法正确的是( )。
| A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0 |
| B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反 |
C.对于N2(g)+3H2(g) 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 |
| D.100 ℃时水的离子积常数KW为5.5×10-13,说明水的电离是放热反应 |
在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3—(aq)。测得不同温度下该反应的平衡常数K如表所示:
I3—(aq)。测得不同温度下该反应的平衡常数K如表所示:
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1 100 | 841 | 689 | 533 | 409 |
下列说法正确的是( )。
A.反应I2(aq)+I-(aq)
 I3—(aq)的ΔH>0
I3—(aq)的ΔH>0B.其他条件不变,升高温度,溶液中c(I3—)减小
C.该反应的平衡常数表达式为K=
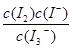
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689
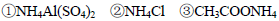
 由大到小的顺序是
由大到小的顺序是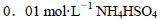 溶液中滴加NaOH溶液至中性:
溶液中滴加NaOH溶液至中性: