题目内容
16.NaHCO3、NaHS、Na2HPO4等溶液显碱性,其酸式酸根离子的电离程度小于水解程度.则[CO32-]<[H2CO3],[S2-]<[H2S],[PO43-]<[H2PO4-](填“>”“<”)分析 NaHCO3、NaHS、Na2HPO4等溶液显碱性,其酸式酸根离子的电离程度小于水解程度,导致酸根离子浓度小于酸浓度,据此分析解答.
解答 解:NaHCO3、NaHS、Na2HPO4等溶液显碱性,其酸式酸根离子的电离程度小于水解程度,导致酸根离子浓度小于酸浓度,但其浓度都较小,所以存在[CO32-]<[H2CO3],[S2-]<[H2S],[PO43-]<[H2PO4-],
故答案为:<;<;<.
点评 本题考查离子浓度大小比较,正确获取题给信息并利用信息是解本题关键,注意弱酸酸式酸根离子水解程度和电离程度都较小,多元弱酸第一步水解程度大于第二步水解程度,根据溶液酸碱性判断酸式酸根离子水解程度和电离程度相对大小,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
7.某电中性溶液中含有K+、Mg2+、Cl-、SO42-四种离子,其中K+、Mg2+、Cl-的个数比为5:2:3,则溶液中Mg2+与SO42-的个数比为( )
| A. | 1:2 | B. | 1:3 | C. | 2:3 | D. | 3:5 |
4.只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂是( )
| A. | Fe(NO3)3溶液 | B. | FeCl2溶液 | C. | BaCl2溶液 | D. | FeCl3溶液 |
11.对于任意一个化学平衡体系,采取下列措施,一定会使平衡发生移动的是( )
| A. | 加入一种反应物 | B. | 增大体系的压强 | C. | 升高温度 | D. | 扩大容器体积 |
1.把下列四种X溶液分别加入四个盛有10mL 2mol•L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应速率最快的是( )
| A. | 10℃20mL3 mol•L-1的X溶液 | B. | 20℃30 mL 2 mol•L-1的X溶液 | ||
| C. | 20℃10 mL 4 mol•L-1的X溶液 | D. | 10℃10 mL 2 mol•L-1的X溶液 |
8.用CH4催化还原NOx可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
| A. | 由反应①知CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数相同 | |
| C. | 0.2 mol CH4还原NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为1.60 mol |
5.有科学家认为:硅是“21世纪的能源”、“未来的石油”,下列有关硅可能成为新型能源的依据的叙述中不正确的是( )
| A. | 自然界存在大量硅单质 | |
| B. | 自然界的硅易开采,且可再生 | |
| C. | 硅燃料便于运输、贮存,从安全角度考虑,硅是优质燃料 | |
| D. | 硅燃料燃烧放出的热量多,其燃烧产物对环境的污染容易有效地控制 |
6.某课外学习小组在学习了Na2O2与CO2的反应后,认为Na2O2与SO2应该也可以反应.他们设计了下图装置(夹持装置已略去,装置的气密性良好)进行实验,探究SO2与Na2O2反应的产物,请按要求回答下列问题.
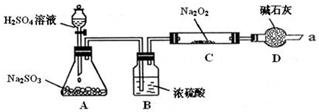
写出装置A中发生反应的化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以吸收尾气在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;假设2:只有Na2SO4;假设3:既有Na2SO3,又有Na2SO4.
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式:2Na2O2+2SO2=2Na2SO3+O2↑.
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4,该方案是否合理否否(填“是”或“否”),理由是硝酸有强氧化性,硝酸可以将BaSO3沉淀氧化为BaSO4
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表.
步骤②中将产生的气体通入少量酸性KMnO4溶液中,发生反应的离子方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.

写出装置A中发生反应的化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以吸收尾气在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;假设2:只有Na2SO4;假设3:既有Na2SO3,又有Na2SO4.
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式:2Na2O2+2SO2=2Na2SO3+O2↑.
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4,该方案是否合理否否(填“是”或“否”),理由是硝酸有强氧化性,硝酸可以将BaSO3沉淀氧化为BaSO4
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表.
| 实验步骤 | 现象 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解. | 固体全部溶解 |
| ②向上试管中加入过量的稀盐酸,将产生的气体通入少量酸性KMnO4溶液中. | KMnO4溶液紫色褪去 |
| ③向步骤②反应后的试管中,加入适量的BaCl2溶液. | 产生白色沉淀 |