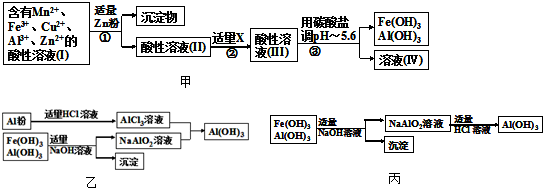
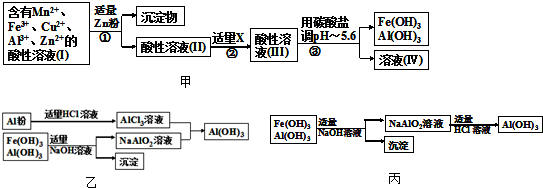
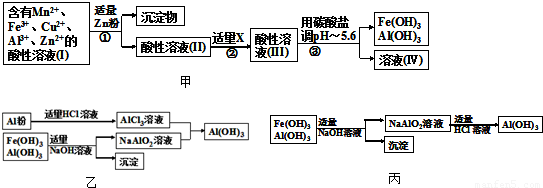
题目内容
将一定的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为V1(V1>0).将反应后的固体残渣与过量的稀盐酸反应,又生成CO2的体积为V2(V1、V2均为标准状况的体积).则原混合物中NaOH和NaHCO3的物质的量之比为
- A.(V2-V1):(V1+V2)
- B.V2:V1
- C.V2:(V1+V2)
- D.(V1+V2):(V2-V1)
分析:NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为V1(V1>0),则剩余固体残渣为Na2CO3,剩余固体残渣与盐酸反应生成CO2的体积为V2,根据碳元素守恒可知碳酸钠的物质的量等于固体残渣与盐酸反应生成CO2的物质的量.根据碳元素守恒可知NaHCO3的物质的量等于两次生成的二氧化碳总的物质的量.令NaOH和NaHCO3的物质的量分别为xmol、ymol,根据钠元素守恒、碳元素守恒列方程计算.
解答:NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为V1(V1>0),则剩余固体残渣为
Na2CO3,剩余固体残渣与盐酸反应生成CO2的体积为V2,根据碳元素守恒可知碳酸钠的物质的量等于固体残渣与盐酸反应生成CO2的物质的量.根据碳元素守恒可知NaHCO3的物质的量等于两次生成的二氧化碳总的物质的量.令NaOH和NaHCO3的物质的量分别为xmol、ymol,则:
根据钠元素守恒有x+y=
 ×2
×2根据碳元素守恒有y=

联立解得x=
 ×2-
×2- =
=
所以原混合物中NaOH和NaHCO3的物质的量之比
 :
: =(V2-V1):(V1+V2).
=(V2-V1):(V1+V2).故选:A.
点评:考查混合物的计算,难度中等,判断剩余固体残渣为Na2CO3是解题关键,利用常规解法比较繁琐,本题采取守恒计算,简化计算.注意守恒思想的运用.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案 ①4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
![]()
③SO3+H2O ![]() H2SO4
H2SO4
其中排放的尾气含少量SO2,为防止污染大气,在排放前应设法进行综合利用。
(1)某硫酸厂每天排放10000m3(换算成标准状况下体积)尾气中含0.2%(体积分数)的SO2,问用NaOH溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(2)如果将一定体积的尾气通入100mL2mol·L-1的NaOH溶液使其完全反应,经测定所得溶液含
(3)工厂在尾气处理制石膏的过程中,中间产物是NaHSO3,调节尾气排放的流量,以取得SO2和NaOH间物质的量的最佳比值,从而提高NaHSO3的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示SO2、NaOH、NaHSO3的物质的量,且![]() =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
x=n(SO2)/n(NaOH) | n(NaHSO3) |
|
|
|
|
|
|
提示:该题取材于接触法制硫酸的过程中对废气SO2的处理,即消除了SO2对空气的污染,又使SO2得到综合利用。该题在能力要求上有一定的深度和坡度。第(1)步考查多步反应的计算,所发生的一系列反应较为复杂,但根据S元素守恒找出关系式,即可得出答案。第(2)步涉及平行反应中混合物的计算。反应方程式为2NaOH+SO2 ![]() Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2 ![]() NaHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
NaHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
接触法制H2SO4的基本原理是:
①4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
②2SO2+O2 ![]() 2SO3
2SO3
③SO3+H2O ![]() H2SO4
H2SO4
其中排放的尾气含少量SO2,为防止污染大气,在排放前应设法进行综合利用。
(1)某硫酸厂每天排放10000m3(换算成标准状况下体积)尾气中含0.2%(体积分数)的SO2,问用NaOH溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(2)如果将一定体积的尾气通入100mL2mol·L-1的NaOH溶液使其完全反应,经测定所得溶液含16.7g溶质。试分析溶液的成分,并计算各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是NaHSO3,调节尾气排放的流量,以取得SO2和NaOH间物质的量的最佳比值,从而提高NaHSO3的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示SO2、NaOH、NaHSO3的物质的量,且![]() =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
| x=n(SO2)/n(NaOH) | n(NaHSO3) |
提示:该题取材于接触法制硫酸的过程中对废气SO2的处理,即消除了SO2对空气的污染,又使SO2得到综合利用。该题在能力要求上有一定的深度和坡度。第(1)步考查多步反应的计算,所发生的一系列反应较为复杂,但根据S元素守恒找出关系式,即可得出答案。第(2)步涉及平行反应中混合物的计算。反应方程式为2NaOH+SO2 ![]() Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2 ![]() aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。