题目内容
下列图示与对应的叙述相符的是


| A.图I表示向1L浓度均为0.1 mol/L的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol/L稀H2SO4溶液,产生沉淀量的变化 |
| B.图Ⅱ中逆反应的热效应△H=E1- E2 <0,所以逆反应为放热反应 |
| C.图Ⅲ表示向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液,溶液pH的变化,c点溶液中:c(HCO3一)+2c(CO32一)+c(C1-)>c(Na+) |
| D.用0.1 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由图Ⅳ曲线可确定HX的酸性最强 |
C
试题分析:A.首先发生反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,然后发生反应:H++ AlO2-+H2O=Al(OH)3↓; Al(OH)3+3H+=Al3++ 3H2O.错误。B.图Ⅱ中正反应的热效应△H=E1- E2 <0,所以逆反应为放热反应。错误。C. Na2CO3是强碱弱酸盐,水解消耗水电离产生的H+使溶液显碱性,当向溶液中加入HCl时发生反应:CO32一+H+= HCO3一;随着HCl的不断滴入,继续发生反应HCO3一+H+= H2CO3。根据电荷守恒可得c(HCO3一)+2c(CO32一)+c(C1-)+c(OH-)=c(Na+)+c(H+).C点的溶液为酸性溶液。c(H+)>c(OH-),所以c(HCO3一)+2c(CO32一)+c(C1-)>c(Na+)。正确。D. 由滴定曲线图可以看出: 三种一元酸的浓度相同,但是c(H+)不同,HZ的pH最小,说明HZ的酸性最强;HX的pH最大,则HX酸性最弱。错误。

练习册系列答案
相关题目


 2CO(g)的ΔH3>+172.5 kJ·mol-1
2CO(g)的ΔH3>+172.5 kJ·mol-1 2NH3+O2
2NH3+O2
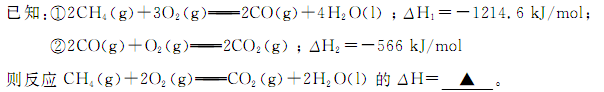
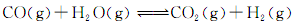 ,得到如下三组数据:
,得到如下三组数据: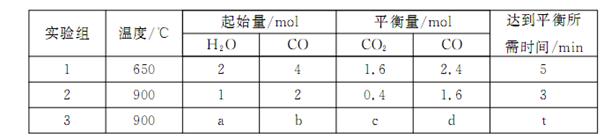

 CO(g)的反应热为-110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1
CO(g)的反应热为-110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1 HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3-+ H+ Ka1(H2CO3)=4.45×10-7