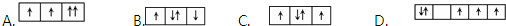题目内容
5.已知反应Cl2+2NaI=2NaCl+I2,把一定量的Cl2通入300gNaI固体中,反应一段时间后,加热,固体的质量为281.7g,把剩下固体加入水配成5L溶液.(已知Na-23 Cl-35.5 I2在加热条件下升华)(1)通过的Cl2在标准状况下的体积.
(2)溶液中溶质的物质的量的浓度.
分析 把一定量的Cl2通入300gNaI固体中,反应一段时间后,加热,固体的质量为281.7g,根据固体质量差量法可以计算得到氯化钠的质量以及消耗的氯气的物质的量,结合c=$\frac{n}{V}$来计算溶质的物质的量的浓度.
解答 解:设通过的Cl2的物质的量是n,质量是71n,产生的碘单质的物质的量是m,质量是254m,
Cl2+2NaI=2NaCl+I2,固体质量减少
71 300 117 254 183
71n 254m 300g-281.7g
$\frac{71}{71n}=\frac{254}{254m}$=$\frac{183}{300g-281.7g}$,解得n=0.1mol,m=0.1mol.
(1)通过的Cl2在标准状况下的体积V=0.1mol×22.4L/mol=2.24L,
答:通过的Cl2在标准状况下的体积是2.24L;
(2)溶液中溶质KCl的物质的量的浓度c=$\frac{0.1mol}{5L}$=0.02mol/L,
答:溶液中溶质的物质的量的浓度是0.02mol/L.
点评 本题考查差量法在化学反应中的计算知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
15.下列有关热化学方程式的叙述正确的是( )
| A. | 已知2H2O(l)═2H2(g)+O2(g)△H=+571.6KJ•mol-1,无法求H2的燃烧热 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,无法比较二者的稳定性 | |
| C. | 已知500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放出19.3KJ的热量,无法推出该反应的热化学方程式 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,无法得出△H2>△H1 |
16.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2═2Fe3++2Br-.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2═2Fe3++2Br-.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
13. 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 1molAl与足量的该硫酸反应产生3g氢气 | |
| C. | 这种硫酸在常温下不能使铁钝化 | |
| D. | 配制80mL2.3mol•L-1的稀硫酸需量取该硫酸10mL |
1.丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如图1所示:CH2=CHCOOH+HOCH3→CH2=CHCOOCH3+H2O
①取10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热.
②充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性.
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分.
可能用到的信息:
回答下列问题:
(1)仪器c的名称是分液漏斗.
(2)混合液用5%Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度).
(3)请写出配制100g 5%Na2CO3溶液的所使用的玻璃仪器烧杯、玻璃棒、量筒.
(4)关于产品的蒸馏操作(夹持装置未画出),图2中有2处错误,请分别写出温度计水银球位置、尾接管与锥形瓶接口密封.

为检验产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10.00mL,加热使之完全水解.
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCl溶液,滴到终点时共消耗盐酸20.00mL.
(5)计算本次酯化反应丙烯酸的转化率54.0%.
(6)请列举2条本实验中需要采取的安全防护措施通风橱中实验、防止明火.
①取10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热.
②充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性.
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分.
可能用到的信息:
| 沸点 | 溶解性 | ||
| 丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
(1)仪器c的名称是分液漏斗.
(2)混合液用5%Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度).
(3)请写出配制100g 5%Na2CO3溶液的所使用的玻璃仪器烧杯、玻璃棒、量筒.
(4)关于产品的蒸馏操作(夹持装置未画出),图2中有2处错误,请分别写出温度计水银球位置、尾接管与锥形瓶接口密封.

为检验产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10.00mL,加热使之完全水解.
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCl溶液,滴到终点时共消耗盐酸20.00mL.
(5)计算本次酯化反应丙烯酸的转化率54.0%.
(6)请列举2条本实验中需要采取的安全防护措施通风橱中实验、防止明火.
5.短周期元素X、Y、Z、W的原子序数依次增大,X、W处于同一主族,且元素X的化合价没有正价,Y、Z、W最高价氧化物对应的水化物两两之间都能反应.则下列说法不正确的是( )
| A. | 简单离子半径大小顺序:rX>rY>rZ | |
| B. | W的单质和水反应生成两种强电解质 | |
| C. | Y、Z的单质均可通过电解制得 | |
| D. | X的气态氢化物的热稳定性比W的强 |