题目内容
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,18gD2O中所含的质子数为10NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| C. | 28gN2和CO的混合气体中含有的分子数为NA | |
| D. | 5.6g铁与足量稀硫酸反应失去电子数为0.3NA |
分析 A、重水的摩尔质量为20g/mol;
B、氧气反应后的价态可能为-2价,也可能为-1价;
C、N2和CO的摩尔质量均为28g/mol;
D、求出铁的物质的量,而反应后铁的价态为+2价.
解答 解:A、重水的摩尔质量为20g/mol,18gD2O的物质的量n=$\frac{18g}{20g/mol}$=0.9mol,而1mol重水中含10mol质子,故0.9mol重水中所含的质子数为9NA,故A错误;
B、标准状况下,11.2LO2的物质的量为0.5mol,而氧气反应后的价态可能为-2价,也可能为-1价,故0.5mol氧气反应转移可能转移2mol电子,也可能转移1mol电子,故B错误;
C、N2和CO的摩尔质量均为28g/mol,28gN2和CO混合气体的物质的量为1mol,故含有的分子数为NA,故C正确;
D、5.6g铁的物质的量为0.1mol,而铁与稀硫酸反应后铁的价态为+2价,故0.1mol铁失去0.2mol电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
19.下列实验不合理的是( )
| A. | 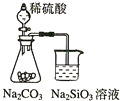 证明非金属性强弱 S>C>Si | B. | 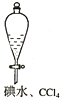 四氯化碳萃取碘水中的碘 | ||
| C. | 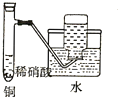 制备并收集少量NO气体 | D. | 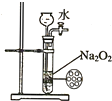 制备少量氧气 |
16.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
| A. | x的原子半径大于y的原子半径 | B. | x的电负性大于y的电负性 | ||
| C. | x的能层数等于y的能层数 | D. | x的第一电离能小于y的第一电离能 |
18.硫酸的消耗量是衡量一个国家化学工业发展水平的重要标志,H2SO4的相对分子质量为( )
| A. | 34 | B. | 98 | C. | 114 | D. | 128 |
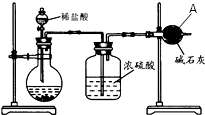 为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)
为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)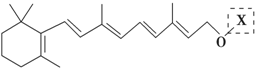 在研究其性能的过程中,发现结构片段X对化合物A的性能起了重要作用.为了研究X的结构,将化合物A在一定条件下水解只得到B(
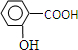
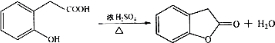
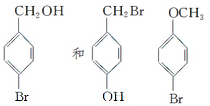
在研究其性能的过程中,发现结构片段X对化合物A的性能起了重要作用.为了研究X的结构,将化合物A在一定条件下水解只得到B(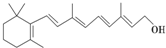 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生. .
. .
. .
. .
.