题目内容
B.水玻璃可作光导纤维
C.Fe2O3用作红色油漆和涂料
D.漂白粉可作环境消毒剂

 阅读快车系列答案
阅读快车系列答案金属铁用途广泛,高炉炼铁的总反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),请回答下列问题:
2Fe(s)+3CO2(g),请回答下列问题:
(1)一定温度下,在体积固定的密闭容器中发生上述反应,可以判断该反应已经达到平衡的是 。
A.密闭容器中总压强不变
B.密闭容器中混合气体的平均摩尔质量不变
C.密闭容器中混合气体的密度不变
D.c(CO)= c(CO2)
E.Fe2O3的质量不再变化
(2)一定温度下,上述反应的化学平衡常数为3.0,该温度下将4molCO、2molFe2O3、6molCO2、5molFe加入容积为2L的密闭容器中,此时反应将向 反应方向进行(填“正”或“逆”或“处于平衡状态”);反应达平衡后,若升高温度,CO与CO2的体积比增大,则正反应为 反应(填“吸热”或“放热”) 。
(3)已知:3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) △H=–47
kJ/mol
2Fe3O4(s)+CO2(g) △H=–47
kJ/mol
Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) △H=
+19 kJ/mol
3FeO(s)+CO2(g) △H=
+19 kJ/mol
FeO(s)+CO(g) Fe(s)+CO2(g) △H=–11 kJ/mol
Fe(s)+CO2(g) △H=–11 kJ/mol
则Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)的△H=
。
2Fe(s)+3CO2(g)的△H=
。
(4)上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
|
温度 |
250℃ ~ 600℃ ~ 1000℃ ~ 2000℃ |
|
主要成分 |
Fe2O3 Fe3O4 FeO Fe |
800℃时固体物质的主要成分为 ,该温度下若测得固体混合物中m(Fe)︰m(O)=105︰32,则Fe3O4被CO还原为FeO的百分率为 (设其它固体杂质中不含Fe、O元素)。
(12分)、X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
|
元素 |
部分结构知识 |
部分性质 |
|
X |
X的单质由双原子分子构成,分子中有14个电子 |
X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
|
Y |
Y原子的次外层电子数等于最外层电子数的一半 |
Y能形成多种气态氧化物 |
|
Z |
Z原子的最外层电子数多于4 |
Z元素的最高正化合价与最低负化合价代数和等于6 |
|
W |
W原子的最外层电子数等于2n-3(n为原子核外电子层数) |
化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)写出X单质的一个重要用途
(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是 (填化学式)。
(3)实验室制备X最简单气态氢化物的化学方程式
(4)将少量Y的最高价氧化物通入硅酸钠溶液中反应的离子方程式
(5)W单质与氢氧化钠溶液反应的离子方程式
(6)Z单质在加热的条件下与浓氢氧化钠溶液反应,氧化产物与还原产物的物质的量之
比为1:5则反应的离子方程式
【解析】X的单质由双原子分子构成,分子中有14个电子,所以X的原子序数是7,即为N。次外层电子数等于最外层电子数的一半的原子是C,即Y是C。最高正化合价与最低负化合价代数和等于6,说明Z属于第 ⅦA。因为F没有正价,所以Z是Cl。最外层电子数等于2n-3(n为原子核外电子层数),则n只能是2或3。又因为W原子易失去最外层电子形成Wn+,所以n等于3,即W是Al。在氯气和氢氧化钠的反应中,还原产物是氯离子,若氧化产物和还原产物的物质的量之比是1︰5,则氧化产物中氯元素的化合价是+5价。即为ClO3-。
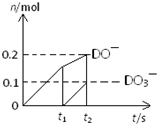
 4NH3
(g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应
(选填编号)。
4NH3
(g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应
(选填编号)。 (N2)/
(N2)/  (O2)=2:3
(O2)=2:3 6H2O↑+
2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是
,每分解1mol高氯酸铵,转移的电子数目是
。
6H2O↑+
2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是
,每分解1mol高氯酸铵,转移的电子数目是
。