题目内容
依据元素周期表及元素周期律,下列推断正确的是
| A.H3BO3的酸性比H2CO3的强 |
| B.Mg(OH)2的碱性比Be(OH)2的强 |
| C.HCl、HBr、HI的热稳定性依次增强 |
| D.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
B
解析

练习册系列答案
相关题目
X、Y、Z、W 属于同周期的短周期主族元素,原子序数依次增大,它们的原子最外层电子数之和为17,且Y原子最外层电子数是X原子最外层电子数的3倍,W的内层电子数比最外层电子数多。下列说法正确的是
| A.原子半径大小:r(X)>r(Y);简单离子半径大小:r(W)>r(Z) |
| B.X、Y、Z最高价氧化物的水化物两两之间可以发生反应 |
| C.氢化物的稳定性:W>Z;氧化物水化物的酸性:W>Z |
| D.甲物质由Y和Z元素组成,溶于水后得到甲的水溶液 |
下列有关物质性质的比较顺序中,不正确的是 ( )
| A.微粒半径:K+>Na+>Mg2+>Al3+ |
| B.热稳定性:HF<HCl<HBr<HI |
| C.酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
| D.熔点:Li>Na>K>Rb |
下列各组物质中,互为同位素的是
A. 和 和 | B.O2和O3 | C.NO和NO2 | D.H2O和H2O2 |
X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
| A.HX | B.H2X | C.XH4 | D.XH3 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是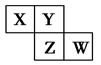
| A.元素Y和元素Z的最高正化合价相同 |
| B.单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z) |
| C.气态氢化物稳定性:X <Y<Z<W |
| D.元素W的最高价氧化物对应的水化物是强酸 |
短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是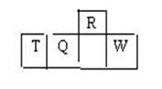
| A.最简单气态氢化物的热稳定性:R>Q |
| B.最高价氧化物对应水化物的酸性:Q<W |
| C.原子半径:T>Q>R |
| D.含T的盐溶液一定显酸性 |
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是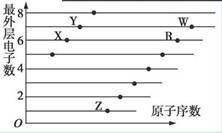
| A.X和R在同一周期 |
| B.原子半径:W>R>X |
| C.气态氢化物的稳定性:X>Y |
| D.X、Z形成的化合物中可能含有共价键 |