题目内容
(12分)碱式碳酸铜[Cu2(OH)2C03]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
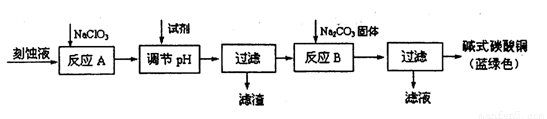
查阅资料知,通过调节溶液的酸碱性可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1,4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
(1)氯酸钠的作用是 ;
(2)调节溶液A的pH范围为 ,可以选择的试剂是 .(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是 ;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是 。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式: 。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净 。
(1)将Fe2+氧化成Fe3+ (2)3.7~6.0 cd (3)水浴加热 CuO
(4)2Cu2++3CO32-+2H2O=Cu2(OH)2CO3+2HCO3-
(5)取最后一次洗涤液,加入硝酸银、硝酸溶液,无沉淀生成则表明已洗净
【解析】(1)由于沉淀氢氧化亚铁的pH大于沉淀氢氧化铁的pH,所以应该把亚铁离子氧化生成铁离子,然后再沉淀,所以氯酸钠的作用是将Fe2+氧化成Fe3+ 。
(2)根据表中数据可知,要沉淀氢氧化铁,而不沉淀氢氧化铜,则溶液的pH应该控制在3.7~6.0之间;由于不能引入杂质,所以选择的试剂是cd。
(3)要控制在60℃左右,且保持恒温,可采用的加热方法应该是水浴加热;如果温度过高,则氢氧化铜会分解生成黑色的氧化铜。
(4)根据反应物和生成物可得出反应的方程式为
2Cu2++3CO32-+2H2O=Cu2(OH)2CO3+2HCO3-。
(5)由于沉淀表面含有吸附的氯离子,所以可以通过检验氯离子来判断,即取最后一次洗涤液,加入硝酸银、硝酸溶液,无沉淀生成则表明已洗净。

 阅读快车系列答案
阅读快车系列答案
 铁、铜和铝是人类生活中常用的金属.
铁、铜和铝是人类生活中常用的金属.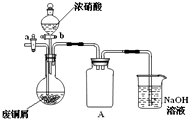 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: