题目内容
【题目】某研究性学习小组设计实验验证以下规律:元素的非金属性越强,对应的最高价氧化物的水化物酸性就越强。该小组设计了如图装置进行实验。拟比较C、Si、S三种元素的非金属性。
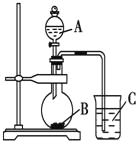
(1)推测三种元素对应的最高价氧化物的水化物酸性由强到弱的顺序是_________________(填化学式)。
(2)若B、C均为正盐,且焰色反应均为黄色。A、B、C的化学式依次为_________、__________、_________(A、C填溶质的化学式)。
(3)烧瓶中的实验现象为________________________________。
(4)固体B也可以用B的溶液代替。实验室配制0.1mol/L的B的溶液450mL,需要用托盘天平称取B_____g。
(5)有同学认为,将A中物质换为浓硝酸,其余试剂不变。则可以验证N、C、Si三元素的非金属性强弱。你认为,该同学的观点___________(选填“正确”“错误”)。理由是__________________。
【答案】H2SO4、H2CO3、H2SiO3(H4SiO4也可,有大于符合也可) H2SO4 Na2CO3 Na2SiO3 有气泡产生(或有气体生成)(强调无色气体也可;说到气味算错) 5.3 错误 硝酸挥发到C中,不能确定与Na2SiO3反应的是碳酸(答到挥发性,或者硝酸与Na2SiO3反应均可)
【解析】
元素的非金属性越强,其最高价含氧酸的酸性越强,由图可知应是利用最高价含氧酸的酸性强弱比较,利用强酸制弱酸原理分析,则
(1)元素的非金属性越强,其最高价含氧酸的酸性越强;
(2)若B、C均为正盐,且焰色反应均为黄色,则为钠盐,即碳酸钠与硅酸钠,据此分析作答;
(3)烧瓶内为硫酸制碳酸的过程,会有二氧化碳生成;
(4)容量瓶有固定的规格;根据m = cVM计算即可;
(5)硝酸易挥发。
(1)C、Si、S的非金属性从大到小为:S > C > Si,所以其最高价含氧酸的酸性由强到弱的顺序为:H2SO4、H2CO3、H2SiO3(H4SiO4也可,有大于符合也可),
故答案为:H2SO4、H2CO3、H2SiO3(H4SiO4也可,有大于符合也可);
(2)有上述分析可知,B为碳酸钠,C为硅酸钠,A为S元素对应最高价氧化物的水化物硫酸,所以其化学式分别为:H2SO4;Na2CO3;Na2SiO3,
故答案为:H2SO4;Na2CO3;Na2SiO3;
(3)根据强酸制弱酸的原理,可知,烧瓶内硫酸会与碳酸钠反应生成二氧化碳、硫酸钠与水,所以其实验现象为:生成气体(或有气体生成);
故答案为:生成气体(或有气体生成);
(4)容量瓶的规格只有500 mL,所以所配制的B溶液的溶质为Na2CO3,其质量为m = cVM = 0.1 mol/L×500×10-3 L×106 g/mol = 5.3 g,
故答案为:5.3 g;
(5)硝酸挥发到C中,不能确定与Na2SiO3反应的是碳酸,因此不能验证N、C、Si三元素的非金属性强弱,
故答案为:错误;验证N、C、Si三元素的非金属性强弱。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
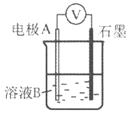
轻松课堂标准练系列答案【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| I | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的 H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验I中铁主要发生了析氢腐蚀,其负极反应式是__________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其理论判断依据是__________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是__________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
V | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验II、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________。
②丁同学对Ⅳ、V进行比较,其目的是探究__________对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是__________。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、V重复进行实验,其设计意图是__________;重复实验时,记录电压表读数依次为c'、d',且c'>d',由此得出的结论是__________。
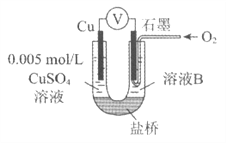
【题目】生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应)。
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在。
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化。
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)。
实验序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
③ | ________ | 7 | 60 | ______ | ______ | 10 |
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示。
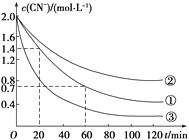
(2)实验①中20~60 min时间段反应速率:v(CN-)=______mol·L-1·min-1。
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是____________________(填一点即可)。在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO,同时放出NH3,试写出该反应的离子方程式:____________。
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他们设计实验并验证上述结论,完成下表中内容(已知:废水中的CN-浓度可用离子色谱仪测定) ______。
实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |