题目内容
【题目】甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。
请回答下列问题:
(1)戊离子的结构示意图为________。
(2)戊的单质与X反应生成的Y和Z的物质的量之比为2∶4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
(3)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:__________________。
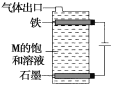
(4)按如图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:____________________________。将充分电解后所得溶液逐滴加入酚酞溶液中,观察到的现象是____________________________。
【答案】(1) (2)2∶3
(2)2∶3
(3)H-+AlO![]() +H2O===Al(OH)3↓
+H2O===Al(OH)3↓
(4)NaCl+H2O![]() NaClO+H2↑ 酚酞溶液先变红后褪色
NaClO+H2↑ 酚酞溶液先变红后褪色
【解析】由信息“甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝”和“原子序数甲<乙”,可确定X是NH3,元素甲为氢(H),乙为氮(N)。再由其他信息推出元素丙为钠(Na),元素戊为氯(Cl),则Cl2与NH3反应可生成N2、NH4Cl和HCl,由“0.1 mol/L的Y溶液pH>1”,确定化合物Y为NH4Cl,Z为HCl。因为丁的单质既能与NaOH溶液反应,又能与HCl溶液反应,均生成盐,则可知丁为铝(Al)。(1)Cl-的结构示意图为 。(2)当Cl2与NH3反应生成NH4Cl和HCl的物质的量之比为2∶4时,反应的化学方程式为:3Cl2+4NH3===N2+2NH4Cl+4HCl,当有3 mol Cl2参加反应时,被氧化的NH3为2 mol,故被氧化的物质与被还原的物质的物质的量之比为2∶3。(3)少量HCl溶液滴入过量NaAlO2溶液中,发生反应的离子方程式为H++AlO
。(2)当Cl2与NH3反应生成NH4Cl和HCl的物质的量之比为2∶4时,反应的化学方程式为:3Cl2+4NH3===N2+2NH4Cl+4HCl,当有3 mol Cl2参加反应时,被氧化的NH3为2 mol,故被氧化的物质与被还原的物质的物质的量之比为2∶3。(3)少量HCl溶液滴入过量NaAlO2溶液中,发生反应的离子方程式为H++AlO![]() +H2O===Al(OH)3↓。(4)电解NaCl饱和溶液的反应化学方程式为:2NaCl+2H2O
+H2O===Al(OH)3↓。(4)电解NaCl饱和溶液的反应化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,生成的Cl2与NaOH反应:Cl2+2NaOH===NaClO+NaCl+H2O,将以上两化学方程式相加得NaCl+H2O
2NaOH+H2↑+Cl2↑,生成的Cl2与NaOH反应:Cl2+2NaOH===NaClO+NaCl+H2O,将以上两化学方程式相加得NaCl+H2O![]() NaClO+H2↑,由于ClO-+H2OHClO+OH-,所以将该溶液加入酚酞溶液中,现象为先变红后褪色。
NaClO+H2↑,由于ClO-+H2OHClO+OH-,所以将该溶液加入酚酞溶液中,现象为先变红后褪色。

 阅读快车系列答案
阅读快车系列答案【题目】氨是重要的化工产品之一,有着广泛的用途,运用化学反应原理的相关知识研究氨的合成及性质对工业生产有着十分重要意义。
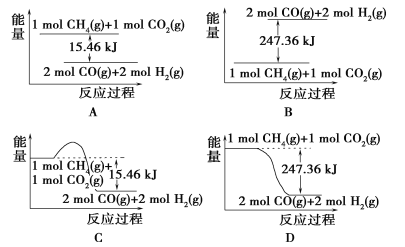
I.合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O (g)反应生成CO (g)和H2 (g)的热化学方程式为______________。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O (g)反应生成CO (g)和H2 (g)的热化学方程式为______________。

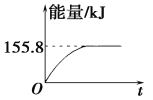
II.恒温下,将一定量N2、H2置于10L的容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.0kJ/mol,反应过程中各物质的物质的量随时间变化如下图。
2NH3(g) △H=-92.0kJ/mol,反应过程中各物质的物质的量随时间变化如下图。

(1)图中0~2s内的反应速率v(NH3)=______;该温度下达平衡时N2的转化率为_____。
(2)若其它条件不变,将恒容条件变为恒压,则平衡时c(N2)__,平衡常数___。(填编号)
A.增大 B.减小 C.不变 D.不能确定
(3)在不同温度下达到平衡时测得NH3的体积分数如下表所示:
T/℃ | 200 | 300 | 400 |
NH3的体积分数 | a1 | a2 | 38% |
①试比较a1、a2的大小:a1_____a2(填“>”、“<”或“=”)。
②若反应在恒容400℃条件下进行,下列能判断反应达到平衡状态的依据有____ (填编号)。
A.断裂1molH-H键同时断裂2molN-H键 B.v正(N2)=3V逆(H2)
C.容器内N2、H2、NH3;的物质的量之比为1:3:2 D.平衡常数保持不变
E.混合气体的平均相对分子质量保持不变 F.混合气体的密度保持不变
(4)工业上合成氨采用了高温高压、催化剂的条件,根据反应判断下列哪些条件有利于提高氨的产率____。
A.采用400℃~500℃高温 B.采用合适的高压
C.使用铁触媒做催化剂 D.将氨液化从体系中分离出来
(5)氨气制取尿素[CO (NH2)2]的反应:2NH3 (g) +CO2(g) ![]() CO (NH2)2 (1)+H2O (g)。
CO (NH2)2 (1)+H2O (g)。
①该反应温度升高,氨气的百分含量增大,则△H______0(填“>”、“<”或“=”)。
②CO的平衡转化率与温度、压强的关系如图所示, 若充入2mol NH3与1mol CO2在2L密闭容器中进行反应,则100℃时反应的平衡常数K=________;压强的大小关系:P1______P2(填“>”、“<”、“=”或“不确定”)。