题目内容
水的电离平衡图像如图所示.
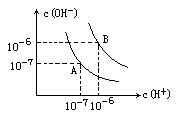
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从________增加到________.
(2)若将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃恒温,欲使混合液pH=7,则Ba(OH)2与盐酸的体积比为________.
答案:
解析:
提示:
解析:
|
(1)10-14,10-12;(2)2∶9 【巧解导析】(1)水是一种极弱的电解质,它存在电离平衡:H2O (2)当温度为100℃时,溶液若为中性,则[H+]=[OH-]=10-6mol·L-1.由于盐酸与Ba(OH)2溶液的混合液pH为7,故此时溶液呈碱性,即Ba(OH)2过量,混合液中[OH-]= 设Ba(OH)2体积为V1,稀盐酸的体积为V2.由题意知: Ba(OH)2溶液中:[OH-]= 解得:9V1=2V2. |
提示:
|
【巧解点悟】解题关键点是要清楚溶液酸碱性与溶液pH的关系.由于温度不同,pH=7的溶液不一定呈中性,只有当溶液中[H+]=[OH-]时溶液才呈中性.解题易错点为:若没有认识到100℃时Ba(OH)2中[OH-]=10-4mol·L-1及混合后溶液pH=7为碱性溶液,就会得出错误答案. |

练习册系列答案
相关题目
 H++OH-,它的电离程度受温度影响,升高温度,水的电离程度增大,因而水的离子积常数也受温度的影响,从图像看,当温度升高到100℃时,[H+]=[OH-]=10-6mol·L-1,此时KW=[H+]·[OH-]=10-12.
H++OH-,它的电离程度受温度影响,升高温度,水的电离程度增大,因而水的离子积常数也受温度的影响,从图像看,当温度升高到100℃时,[H+]=[OH-]=10-6mol·L-1,此时KW=[H+]·[OH-]=10-12.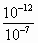 =10-5mol·L-1.
=10-5mol·L-1.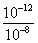 =10-4mol·L-1,
=10-4mol·L-1,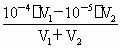 =10-5
=10-5 HCO3-+H+的平衡常数K1=________.(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=________.(已知:10-5.60=2.5×10-6)