题目内容
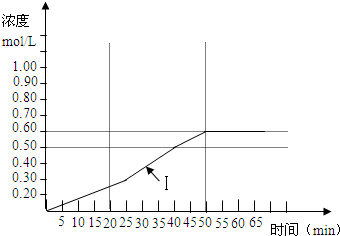
(10分)将1 mol氧气和一定量的HCl放入一定体积的密闭容器中,420℃时,在
催化剂作用下发生反应:4HCl+O2 ![]() 2Cl2+2H2O。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
2Cl2+2H2O。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
请回答下列问题:
(1)写出平衡混合气体通入NaOH溶液中所发生反应的化学方程式。
(2)计算平衡时HCl的转化率。
(10分)(1)HCl+NaOH=NaCl+H2O(2分) Cl2+2NaOH=NaCl+NaClO+H2O(2分)
(2)余O2物质的量:![]() =0.6 mol
=0.6 mol
消耗的O2物质的量:1 mol - 0.6 mol = 0.4 mol
生成的Cl2物质的量:0.4 mol ×2 = 0.8 mol
消耗HCl物质的量:0.8 mol ×2 = 1.6 mol(2分)
反应前的HCl物质的量:2 mol(2分)
HCl的转化率:![]() (2分)
(2分)

练习册系列答案
相关题目
 A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:
A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题: