题目内容
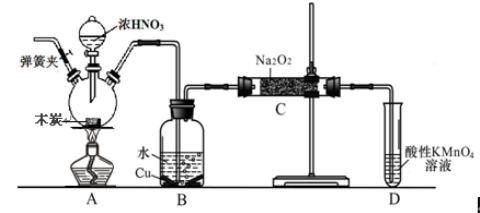
【题目】亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2) B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
【答案】(1)C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(2)铜片逐渐溶解,溶液变为蓝色 吸收未反应的NO
(3)取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色
(4)碱石灰 (5)1.8g
【解析】
试题分析:(1)浓硝酸与木炭反应的化学方程式C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O。
CO2↑+4NO2↑+2H2O。
(2) A中生成的NO2进入B中与水反应生成硝酸,B中铜与稀硝酸反应生成NO和硝酸铜,观察到的主要现象是有无色气体产生和铜片逐渐溶解,溶液变为蓝色,酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+,D装置的作用是吸收未反应的NO。
(3)根据3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O,检验C中产物有亚硝酸钠的方法是取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色。
(4)副产物碳酸钠和氢氧化钠是过氧化钠与二氧化碳、水反应生成的,为避免产生这些副产物应在B、C装置间增加装置,除去二氧化碳、水,则该装置中盛放的药品名称碱石灰。
(5)![]() ,将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭1.8g。
,将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭1.8g。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案【题目】[化学——选修3:物质结构与性质]
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为_________ __________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_ _
氟 | 氯 | 溴 | 碘 | 铍 | |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。I3-离子的中心原子周围σ键电子对对数为___ __,孤电子对对数为__ ____
与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列___ __式发生。
A.CsICl2=CsCl+ICl
B.CsICl2=CsI+Cl2
(5)已知ClO2-为V形,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
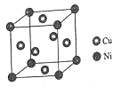
(6)如图为碘晶体晶胞结构。有关说法中正确的是__________。

A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为__________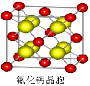 _。
_。
【题目】下列物质的描述和相关知识均正确的是( )
物质及变化 | 描述 | 相关知识 | |
A | 碘化钾溶液滴到土豆片上 | 变蓝色 | 土豆片含淀粉 |
B | 煤的气化 | 化学变化 | 主要反应是碳与水生成水煤气等 |
C | 乙烯和苯 | 都能使溴水褪色 | 分子中含有相同的碳碳双键 |
D | 蔗糖和麦芽糖 | 多糖 | 二者互为同分异构体 |