题目内容
25 ℃时某溶液中由水电离产生的c(H+)=1×10-12 mol·L-1,则该溶液的pH可能为( )A.12 B.7 C.6 D.10
解析:本题考查的是水的电离的实质及pH的计算。由于水电离产生的c(H+)=c(OH-),因此若溶液为酸性,则根据计算可知pH=2;若溶液为碱性,则根据计算可得pH=12。故选A。
答案:A

练习册系列答案
相关题目
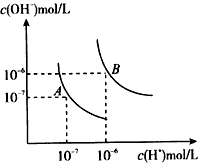
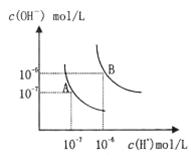
 水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )| A、纯水中25°C时的,c(H+)比100℃的时c(H+)大 | B、100℃时某溶液中由水电离产生的c(H+)═1×10-11mol?L-1,则该溶液的Ph可能是11或3 | C、将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10:1 | D、25℃时,某Na2SO4溶液中c(SO 42-)=5.0×10-4mol/L则溶液中c(Na+):c(OH-)为104:1 |