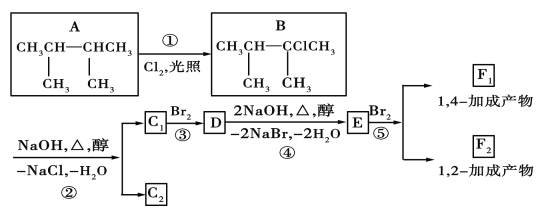
题目内容
【题目】温度相同,向甲、乙两体积相同的密闭容器中,各通入2mol SO2和1 mol O2发生反应;
2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡时,甲容器中SO2的转化率大于乙容器中SO2的转化率。下列判断正确的是 ( )
2SO3(g)达到平衡时,甲容器中SO2的转化率大于乙容器中SO2的转化率。下列判断正确的是 ( )
A.甲保持压强不变,乙保持体积不变
B.甲保持体积不变,乙保持压强不变
C.混合气体密度甲小于乙
D.混合气体的平均相对分子质量甲小于乙
【答案】A
【解析】
A.已知反应:2SO2+O2![]() 2SO3,反应物的化学计量数之和大于生成物的化学计量数之和,随着反应的进行,气体的物质的量逐渐减小,如甲为恒温恒压条件,乙为恒温恒容条件,当同时开始反应都达平衡,甲的压强大于乙的压强,根据增大压强平衡向正反应方向移动可知,甲可看作在乙的基础上增大压强,则平衡向正反应方向移动,则乙中SO2的转化率较低,甲中SO2的转化率较高,A正确;
2SO3,反应物的化学计量数之和大于生成物的化学计量数之和,随着反应的进行,气体的物质的量逐渐减小,如甲为恒温恒压条件,乙为恒温恒容条件,当同时开始反应都达平衡,甲的压强大于乙的压强,根据增大压强平衡向正反应方向移动可知,甲可看作在乙的基础上增大压强,则平衡向正反应方向移动,则乙中SO2的转化率较低,甲中SO2的转化率较高,A正确;
B.根据A选项分析,B错误;
C.混合气体的密度=m/V,甲中体积小,密度大,C错误;
D.混合气体的平均相对分子质量=m/n,甲中n小,平均相对分子质量大,D错误;
答案选A。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目