题目内容
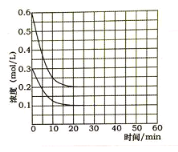
【题目】698 K时,向V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g)2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。

请回答下列问题:
(1)V=________;反应从开始到平衡时,这段时间内平均反应速率v(HI)=_______。
(2)下列说法中可以说明反应2HI(g) H2(g)+I2(g)已达到平衡状态的是___。
A.单位时间内生成n mol H2的同时生成2n mol HI
B.温度和体积一定时,容器内压强不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(3)当反应H2(g)+I2(g) 2HI(g)达到平衡状态时,_____(填“吸收”或“放出”)的热量为___。
(4)恒容下,某时刻加入HI(g),HI(g)的转化率_______(填“增大”、“减小”、“不变”)。
(5)压缩体积,平衡向________移动(填“正反应”、“逆反应”、“不”),气体颜色_______(填“变深”、“变浅”、不变”)
【答案】2 0.316mol·L-1·s-1 A 放出 41.87 kJ 不变 不 变深
【解析】
(1)开始时,通入H2的物质的量为2mol,根据图象,H2的物质的量浓度为1mol·L-1,则V=2L;根据化学反应速率的数学表达式,v(HI)=1.58mol/L÷5s=0.316mol/(L·s);
(2)A、生成H2,反应向正反应方向进行,生成HI,反应向逆反应方向进行,且生成H2的物质的量与生成HI的物质的量之比等于化学计量数之比,因此能说明反应达到平衡,故A符合题意;
B、反应前后气体系数之和相等,且温度一定,因此压强不变,不能说明反应达到平衡,故B不符合题意;
C、组分都是气体,气体总质量不变,反应前后气体系数之和相等,气体总物质的量不变,即摩尔质量不变,不能说明反应达到平衡,故C不符合题意;
D、容积定值,气体质量不变,因此密度不变,不能说明反应达到平衡,故D不符合题意,答案为A;
(3)正反应是放热反应,因此该反应达到平衡时放热,放出的热量为(1-0.21)mol/L×2L×26.5kJ/mol=41.87kJ;
(4)反应前后气体系数之和相等,恒容时,加入HI,与原平衡构成等效平衡,即HI的转化率不变;
(5)反应前后气体系数之和不变,压缩体积,压强增大,平衡不移动,容器的体积缩小,组分浓度变大,气体颜色变深。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案