题目内容
2SO2(g)+O2(g)![]() 2SO3(g);△H=a kJ/mol,反应过程的能量变化如图所示.已知1 mol SO2(g)完全转化为1 mol SO3(g)放热99 kJ.请回答:
2SO3(g);△H=a kJ/mol,反应过程的能量变化如图所示.已知1 mol SO2(g)完全转化为1 mol SO3(g)放热99 kJ.请回答:
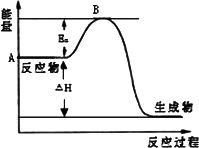
(1)图中A点表示________,a=________.
(2)Ea的大小对该反应的△H________(填“有”或“无”)影响.该反应常用V2O5作催化剂,加入V2O5会使图中B点________(填“升高”、“降低”或“不变”).
(3)已知单质硫的燃烧热为296 kJ·mol-1,写出反应的热化学方程式:________,常温常压下,由单质硫和氧气经两步反应,生成3 mol SO3(g),放出的总热量为________.
答案:
解析:
解析:
|
(1)反应物的(总)能量;-198 (2)无;降低 (3)S(s)+O2(g) |

练习册系列答案
相关题目
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
| A.通入大量O2 | B.增大容器容积 | C.移去部分SO3 | D.降低体系温度 |
 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
 2SO3(g)
△H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g)
△H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是