题目内容
【题目】表是元素周期表的一部分,回答下列有关问题: 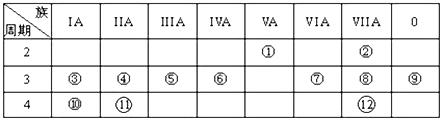
(1)画出⑥的原子结构示意图: , 写出①的气态氢化物分子的电子式 .
(2)元素④、⑩、的最高价氧化物水化物的碱性最强的为;元素②、⑦、⑧的氢化物稳定性由强到弱的顺序为(均用化学式填空).
(3)③与氧形成的化合物R2O2中所含化学键类型为 .
(4)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,有一新型燃料电池,是用两根金属做电极插入KOH溶液中,然后向X极通入A的最简单气态氢化物,向Y极通入O2 , 请写出电极反应式: 负极正极 .
【答案】
(1)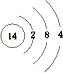 ;
;![]()
(2)KOH;HF>HCl>H2S
(3)离子键、共价键
(4)CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O;O2+2H2O+4e﹣=4OH﹣
【解析】解:由元素在周期表的位置可知,从①开始元素分别为N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br,(1)⑥为Si,原子序数为14,原子结构式为 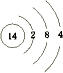 ;①的气态氢化物为氨气,其电子式为
;①的气态氢化物为氨气,其电子式为 ![]() ,所以答案是:
,所以答案是:  ;
; ![]() ;(2)金属性越强,最高价氧化物水化物的碱性越强;非金属性越强,最高价氧化物水化物的酸性越强,则元素④、⑩、的最高价氧化物水化物的碱性最强的为KOH;元素②、⑦、⑧的氢化物稳定性由强到弱的顺序为HF>HCl>H2S,所以答案是:KOH;HF>HCl>H2S;(3)③与氧形成的化合物Na2O2 , 含离子键和共价键,所以答案是:离子键、共价键;(4)与①和⑥都相邻的一种元素A为C,A的最简单气态氢化物为甲烷,向Y极通入O2 , 可知甲烷在负极失去电子,氧气在正极得到电子,则负极反应为CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O,正极反应为O2+2H2O+4e﹣=4OH﹣ , 所以答案是:CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O;O2+2H2O+4e﹣=4OH﹣ .
;(2)金属性越强,最高价氧化物水化物的碱性越强;非金属性越强,最高价氧化物水化物的酸性越强,则元素④、⑩、的最高价氧化物水化物的碱性最强的为KOH;元素②、⑦、⑧的氢化物稳定性由强到弱的顺序为HF>HCl>H2S,所以答案是:KOH;HF>HCl>H2S;(3)③与氧形成的化合物Na2O2 , 含离子键和共价键,所以答案是:离子键、共价键;(4)与①和⑥都相邻的一种元素A为C,A的最简单气态氢化物为甲烷,向Y极通入O2 , 可知甲烷在负极失去电子,氧气在正极得到电子,则负极反应为CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O,正极反应为O2+2H2O+4e﹣=4OH﹣ , 所以答案是:CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O;O2+2H2O+4e﹣=4OH﹣ .

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案

