题目内容
7.下列离子组能大量共存且溶液为无色透明的是( )| A. | H+、Ca2+、Cl-、CO32- | B. | Na+、Cu2+、SO42-、Cl- | ||
| C. | K+、Na+、OH-、Cl- | D. | Ba2+、H+、Cl-、OH- |
分析 A.钙离子与碳酸根离子反应生成碳酸钙沉淀;
B.铜离子为有色离子;
C.四种离子之间不反应,都是无色离子;
D.氢离子与氢氧根离子反应.
解答 解:A.Ca2+、CO32-之间反应生成碳酸钙沉淀,在溶液中不能大量共存,故A错误;
B.Cu2+为有色离子,不满足溶液无色的条件,故B错误;
C.K+、Na+、OH-、Cl-之间不反应,在溶液中能够大量共存,故C正确;
D.H+、OH-之间发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
相关题目
17.关于某有机物 的性质叙述不正确的是( )
的性质叙述不正确的是( )
 的性质叙述不正确的是( )
的性质叙述不正确的是( )| A. | 1 mol该有机物完全燃烧可生成12molCO2 | |
| B. | lmol该有机物分别与足量Na或NaHCO3反应,产生的气体分子数目相等 | |
| C. | 1 mol该有机物可以与5mol H2发生加成反应 | |
| D. | 1 mol该有机物可以与2 molNaOH发生反应 |
18.下列各组中的性质比较正确的是( )
| A. | 稳定性:NH3<PH3<SiH4 | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 碱性:KOH<NaOH<Mg(OH)2 | D. | 还原性:Br->Cl->F- |
15.下列电子式书写错误的是( )
| A. |  | B. |  | C. | 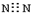 | D. |  |
2.下列关于胶体的叙述中,不正确的是( )
| A. | 利用丁达尔效应是区分胶体与溶液的一种常用物理方法 | |
| B. | 在煮沸的氢氧化钠溶液中滴加5~6滴饱和氯化铁溶液可制得氢氧化铁胶体 | |
| C. | 利用的胶体聚沉的性质在豆浆里加入盐卤做豆腐 | |
| D. | 胶体区别于其它分散系的本质特征是分散至粒子直径的大小 |
4.如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,下列说法错误的是( )

| A. | 该电池可将化学能转化为电能 | |
| B. | 正极反应式为:O2+4e-+2H2O=4OH- | |
| C. | 每消耗0.2mol2CH2=CH2,则溶液中有0.4mole-迁移 | |
| D. | 放电一段时间后磷酸的物质的量不变 |
9.碱性锌锰电池是日常生活中消耗最大的电池,其构造如图1所示.
放电时总反应为:Zn+2H2O+2MnO2=Zn(OH)2+2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图2:

回答下列问题:
(1)MnOOH中,Mn元素的化合价为+3.
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还成MnO),主要原因是“粉料”中含有C.
(3)“净化”为了除去浸出液中的Fe2+,方法是:加入H2O2(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀.已知浸出液中Mi2+、Zn2+的浓度约为0.1mol•L-1,根据下列数据计算,调节pH的合理范围是3至6.
(离子浓度小于1×mol•L-1即为沉淀完全)
(4)“电解”时,阳极的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+.本工艺中应循环利用的物质是H2SO4(填化学式).
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2.“粉料”中的MnOOH与盐酸反应的化学方程式为2MnOOH+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+4H2O+Cl2↑.
放电时总反应为:Zn+2H2O+2MnO2=Zn(OH)2+2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图2:

回答下列问题:
(1)MnOOH中,Mn元素的化合价为+3.
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还成MnO),主要原因是“粉料”中含有C.
(3)“净化”为了除去浸出液中的Fe2+,方法是:加入H2O2(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀.已知浸出液中Mi2+、Zn2+的浓度约为0.1mol•L-1,根据下列数据计算,调节pH的合理范围是3至6.
| 化合物 | Mn(OH)3 | Zn(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-13 | 10-17 | 10-34 |
(4)“电解”时,阳极的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+.本工艺中应循环利用的物质是H2SO4(填化学式).
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2.“粉料”中的MnOOH与盐酸反应的化学方程式为2MnOOH+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+4H2O+Cl2↑.

 .
.