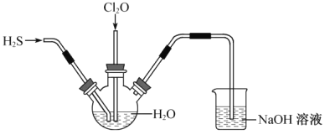
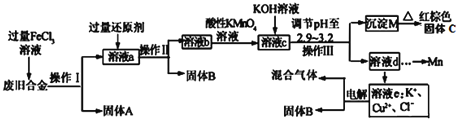
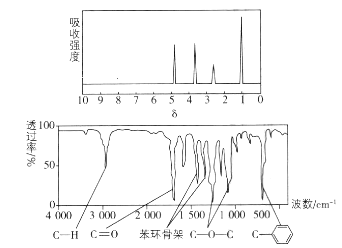
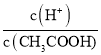题目内容
【题目】6.4g铜投入一定浓度的HNO3中,铜完全溶解,生成NO和NO2的混合气体,用试管全部收集,得到标准状况下的体积为2240mL。请回答:
(1)反应中消耗掉HNO3的物质的量为___mol。
(2)生成NO2的体积(标况)为___mL。
(3)将盛有混合气体的试管倒扣在水槽中,通入标况下的O2,恰好使气体完全溶于水中,则通入O2的体积是___mL。(请写出解答过程)
【答案】0.3 1120 1120
【解析】
铜投入一定浓度的HNO3中,铜完全溶解,生成NO和NO2的混合气体,可认为发生两个反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,可设未知数,建立方程组求解;也可将硝酸的作用分割为酸性和氧化性,然后进行求解。
n(Cu)=![]() =0.1mol,n(NO)+n(NO2)=
=0.1mol,n(NO)+n(NO2)=![]() =0.1mol。
=0.1mol。
(1)n(HNO3)=n(HNO3)酸性+n(HNO3)氧化性=2n(Cu)+n(NO)+n(NO2)=0.1mol×2+0.1mol=0.3mol;答案为:0.3;
(2)设n(NO2)=x,则n(NO)=0.1mol-x,利用电子守恒,可得2×0.1mol=x+3×(0.1mol-x),从而求出x=0.05mol,V(NO2)=0.05mol×22400mL/mol=1120mL;答案为:1120;
(3)因为反应生成的NO、NO2与O2、H2O反应,最终生成HNO3,所以利用终态法,可得出2Cu—O2的关系,从而得出n(O2)=![]() =0.05mol,V(O2)=0.05mol×22400mL/mol=1120mL。答案为:1120。
=0.05mol,V(O2)=0.05mol×22400mL/mol=1120mL。答案为:1120。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目