题目内容
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
(1)判断BaCl2已过量的方法是 。
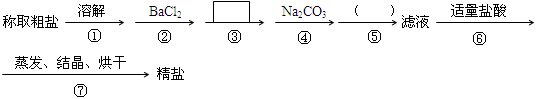
(2)第④步中,写出相应的离子方程式: ; ____________________________.
(3)在 中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
(4)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。)原因是:_______________________ _______ _________________;
步骤③和④可否颠倒____________。
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是: 。
(14分)(1)取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(3分)(合理答案皆可)
(2)Ca2+ + CO32- = CaCO3↓; Ba2+ + CO32- = BaCO3↓(4分)
(3)NaOH 过滤 (2分)
(4)否;过量的BaCl2必须要用Na2CO3除去,步骤复杂; 是 ;(3分)
(5)会有部分沉淀溶解,从而影响制得精盐的纯度(2分)
【解析】
试题分析:(1)取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量。
(2)②步骤中BaCl2过量,所以③步骤溶液中含有阳离子Ba2+、Ca2+, Ba2+、Ca2+遇CO32-沉淀,离子反应方程式如下:Ca2+ + CO32- = CaCO3↓; Ba2+ + CO32- = BaCO3↓。
(3)NaOH为除去Mg2+。过滤是为了除去沉淀。
(4)步骤②和④如果颠倒就会有多余的Ba2+未被除去。
(5)会有部分沉淀溶解,从而影响制得精盐的纯度。
考点:本题着重考查粗盐提取实验。



 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):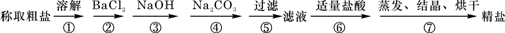

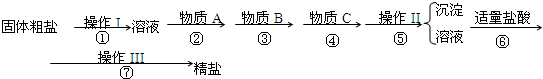
 aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液
aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液