题目内容
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态Fe2+核外电子排布式为___。
(2)在[Fe(CN)6]3-中不存在的化学键有__。
A.共价键 B.金属键 C.配位键 D.离子键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2OKCN+HCl=HCN+KCl
HC≡CH+HCN→H2C=CH-C≡N
①KCNO中非金属元素原子的第一电离能由小到大排序为__。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是__;分子中σ键和π键数目之比为__。
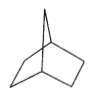
(4)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

关于Fe(CO)5,下列说法正确的是__。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
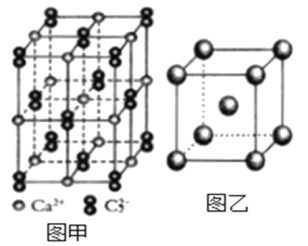
(5)与C22-互为等电子体的微粒__(写出一种),CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为__。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为__nm(用含有d、NA的代数式表示)。
【答案】[Ar]3d6或1s22s22p63s23p63d6 BD C<O<N sp、sp2 2:1 AC N2 4 
【解析】
铁的原子序数为26,基态Fe失去4s上2个电子形成Fe2+;[Fe(CN)6]3-为阴离子,是配合物的内界;KCNO中K为金属元素,易失去电子,第一电离能最小,C、N、O位于第二周期;
丙烯腈中含有碳碳双键和碳氮叁键,双键中含有1个σ键和1个π键、叁键中1个σ键和2个π键;看正负电荷中心是否重叠,分子对称则为非极性分子,不对称的为极性分子;等电子体是原子数与电子数分别相同的物质;铁单质的晶胞模型为体心立方堆积,一个晶胞中铁原子的个数为![]() 。
。
(1)铁的核外电子排布式为[Ar]3d64s2,,基态Fe失去4s上2个电子形成Fe2+,则基态Fe2+核外电子排布式为[Ar]3d6或1s22s22p63s23p63d6。
(2)[Fe(CN)6]3-为阴离子,是配合物的内界,含有配位键,C与N原子间有极性共价键,但金属键存在于金属晶体中,氢键为分子间作用力,不是化学键,故选BD。
(3)①N的核外电子排布为1s22s22p3,为半充满状态,能量最低,则N的第一电离能大于O,C和O位于同一周期,C的原子半径大于O,则C的第一电离能小于O,故第一电离能由小到大排序为C<O<N。
②丙烯腈(H2C=CH-C≡N)分子中碳原子VSEPR构型有两种形式为平面三角形和直线形,故轨道杂化类型是sp、sp2;碳碳双键中含有1个σ键和1个π键、碳氮叁键中1个σ键和2个π键,碳氢单键均为σ键,故分子中σ键和π键的数目之比为6:3=2:1。
(4)A.Fe(CO)5为三角双锥结构,分子中正负电荷分布均匀,则Fe(CO)5对称是非极性分子,CO不对称是极性分子,A正确;
B.铁的杂化轨道数为5,与5个CO形成5个配位键,不是sp3杂化,B错误;
C.1个Fe(CO)5中铁原子与5个CO形成配位键,在每个CO分子中含有1个配位键,故有10mol配位键,故1molFe(CO)5含有10mol配位键,C正确;
D.反应Fe(CO)5=Fe+5CO属于化学变化,化学反应的实质为旧化学键断裂和新化学键形成,故反应中有新化学键生成,D错误;
答案选AC。
(5)等电子体是原子数与电子数分别相同的物质,C22-的原子数为2,电子数为14,则与其互为等电子体的微粒有N2、O22+等;依据晶胞示意图可知,晶胞的一个平面的长与宽不相等,再由体心的Ca2+可知,晶体中每个Ca2+周围距离最近的C22-数目为4。
(6)由图可知,铁单质的晶胞模型为体心立方堆积,一个晶胞中铁原子的个数为![]() ,则晶胞的质量为
,则晶胞的质量为![]() ,则为晶胞的体积为
,则为晶胞的体积为![]() ,边长为
,边长为 ,铁原子的半径r与晶胞边长a的关系为4r=
,铁原子的半径r与晶胞边长a的关系为4r=![]() a,故铁原子的半径为
a,故铁原子的半径为 。
。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验现象、结论及其推理都正确的是 ( )
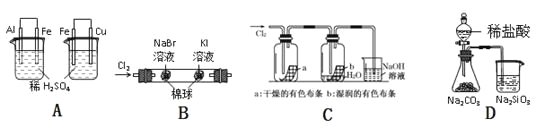
实验 | 实验现象 | 结论 |
A | 左烧杯中铁不断溶解,右烧杯中铁表面有气泡 | 活动性:Al>Fe>Cu |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | a中布条不褪色,b中布条褪色 | 干燥氯气无漂白性,潮湿的氯气有漂泊性 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D
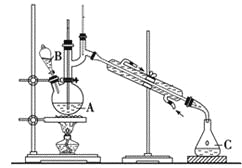
【题目】某实验小组利用如下装置合成化工原料正丁醛。发生的反应如下:
![]()
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在C中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,再将有机层干燥、蒸馏后得正丁醛2.0 g。
回答下列问题:
(1)实验中不能将Na2Cr2O7溶液加到浓硫酸中的理由是_____________________。
(2)加入沸石的作用是_________________。
(3)分液漏斗使用前必须进行的操作是__________________。
(4)反应温度应保持在90~95℃,其原因是___________________。
(5)本实验中,正丁醛的产率为___________________。