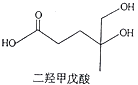
题目内容
【题目】在乙烯分子中有5个σ键、一个π键,它们分别是( )。
A.未杂化的sp2轨道形成σ键、杂化的2p轨道形成π键
B.杂化的sp2轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间有未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间有未参加杂化的2p轨道形成的π键
【答案】C
【解析】
乙烯中存在4个C-H键和1个C=C双键,没有孤对电子,成键数为3,则C原子采取sp2杂化,C-H之间是sp2形成的σ键,C-C之间有1个是sp2形成的σ键,C-C之间还有1个是未参加杂化的2p轨道形成的π键,选项C符合题意,故答案为C。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】现有下列短周期元素相关性质的数据:
元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
原子半径(10﹣10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
最低负化合价 | ﹣2 | ﹣3 | ﹣1 | ﹣3 |
试回答下列问题:
(1)元素⑤在周期表中的位置;
(2)元素④与元素⑦相比较,气态氢化物较稳定的是(填结构式);
(3)元素④形成的+3和+5价的氯化物中,各原子均达到8电子稳定结构的化合物是(写化学式);
(4)以下叙述正确的是 .
A.氢化物的沸点为④<⑦
B.①与②形成的化合物具有两性
C.与稀盐酸反应单质②比单质⑥快
D.最高价氧化物对应水化物的碱性③>⑥
【题目】X、Y、Z、W为四种短周期元素,有关这四种元素的说法一定正确的是
元素 | X | Y | Z | W |
原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
最高正价或最低负价 | +4 | +5 | -2 | -1 |
A. Z处于元素周期表中第2周期VIA族
B. X、Y都可与氧元素形成多种氧化物
C. Y的氢化物与W的氢化物反应生成的产物中只含有共价键
D. X与W形成的化合物的电子式可表示为![]()