题目内容
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如图1所示:

(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为Fe的低价氧化物.该过程中两个主要反应的化学方程式分别是______、______,反射炉内生成炉渣的主要成分是______;
(2)冰铜(Cu2S 和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程中发生反应的化学方程式分别是______、______;
(3)粗铜的电解精炼如图2所示.在粗铜的电解过程中,粗铜板应是图中电极______(填图中的字母);在电极d上发生的电极反应式为______,若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______.
解:(1)黄铜矿与空气反应生成Cu2S、FeS,根据化合价升降相等配平,反应方程式为:2CuFeS2+O2  Cu2S+2FeS+SO2;FeS和氧气反应生成FeO,根据化合价升降相等,配平方程式为:FeS+3O2
Cu2S+2FeS+SO2;FeS和氧气反应生成FeO,根据化合价升降相等,配平方程式为:FeS+3O2  2FeO+2SO2,生成炉渣的主要成分为:FeSiO3,
2FeO+2SO2,生成炉渣的主要成分为:FeSiO3,
故答案是:2CuFeS2+O2 Cu2S+2FeS+SO2;FeS+3O2
Cu2S+2FeS+SO2;FeS+3O2  2FeO+2SO2 FeSiO3;
2FeO+2SO2 FeSiO3;
(2)Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2 2Cu2O+2SO2;Cu2O与Cu2S发生反应的方程式为:2Cu2O+Cu2S
2Cu2O+2SO2;Cu2O与Cu2S发生反应的方程式为:2Cu2O+Cu2S  6Cu+2SO2↑,
6Cu+2SO2↑,
故答案是:2Cu2S+3O2 2Cu2O+2SO2;2Cu2O+Cu2S
2Cu2O+2SO2;2Cu2O+Cu2S  6Cu+2SO2↑;
6Cu+2SO2↑;
(3)c连电源正极,d连电源的负极;故c为阳极,d为阴极;粗铜板应放在阳极,即c;d阴极发生还原反应,方程式为:Cu2++2e-=Cu;Au、Ag比较稳定,不反应,以单质形式沉积在c(阳极)下方,Fe失去电子变成Fe2+的形式进入电解液中,
故答案是:c;Cu2++2e-=Cu;Au、Ag以单质形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解液中.
分析:(1)黄铜矿与空气反应生成Cu和Fe的低价硫化物:产物为Cu2S、FeS;部分Fe的硫化物转变为Fe的低价氧化物:产物为FeO;反射炉内生成炉渣的主要成分是FeSiO3;
(2)Cu2S被氧化为Cu2O:2Cu2S+3O2 2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S
2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S  6Cu+2SO2↑;
6Cu+2SO2↑;
(3)粗铜应该放在阳极,c是阳极;d是阴极,发生还原反应 Cu2++2e-=Cu;粗铜中的Au、Ag、,它们在电解槽中的下方,以单质形式沉积在c(阳极)下方;Fe以Fe2+的形式进入电解液中.
点评:本题考查铜及其化合物的性质,特别是阅读信息、处理信息的能力,难度稍大.
 Cu2S+2FeS+SO2;FeS和氧气反应生成FeO,根据化合价升降相等,配平方程式为:FeS+3O2
Cu2S+2FeS+SO2;FeS和氧气反应生成FeO,根据化合价升降相等,配平方程式为:FeS+3O2  2FeO+2SO2,生成炉渣的主要成分为:FeSiO3,
2FeO+2SO2,生成炉渣的主要成分为:FeSiO3,故答案是:2CuFeS2+O2
 Cu2S+2FeS+SO2;FeS+3O2
Cu2S+2FeS+SO2;FeS+3O2  2FeO+2SO2 FeSiO3;
2FeO+2SO2 FeSiO3;(2)Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2
 2Cu2O+2SO2;Cu2O与Cu2S发生反应的方程式为:2Cu2O+Cu2S
2Cu2O+2SO2;Cu2O与Cu2S发生反应的方程式为:2Cu2O+Cu2S  6Cu+2SO2↑,
6Cu+2SO2↑,故答案是:2Cu2S+3O2
 2Cu2O+2SO2;2Cu2O+Cu2S
2Cu2O+2SO2;2Cu2O+Cu2S  6Cu+2SO2↑;
6Cu+2SO2↑;(3)c连电源正极,d连电源的负极;故c为阳极,d为阴极;粗铜板应放在阳极,即c;d阴极发生还原反应,方程式为:Cu2++2e-=Cu;Au、Ag比较稳定,不反应,以单质形式沉积在c(阳极)下方,Fe失去电子变成Fe2+的形式进入电解液中,
故答案是:c;Cu2++2e-=Cu;Au、Ag以单质形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解液中.
分析:(1)黄铜矿与空气反应生成Cu和Fe的低价硫化物:产物为Cu2S、FeS;部分Fe的硫化物转变为Fe的低价氧化物:产物为FeO;反射炉内生成炉渣的主要成分是FeSiO3;
(2)Cu2S被氧化为Cu2O:2Cu2S+3O2
 2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S
2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S  6Cu+2SO2↑;
6Cu+2SO2↑;(3)粗铜应该放在阳极,c是阳极;d是阴极,发生还原反应 Cu2++2e-=Cu;粗铜中的Au、Ag、,它们在电解槽中的下方,以单质形式沉积在c(阳极)下方;Fe以Fe2+的形式进入电解液中.
点评:本题考查铜及其化合物的性质,特别是阅读信息、处理信息的能力,难度稍大.

练习册系列答案
相关题目

 由黄铜矿(主要成分是CuFeS2)可以冶炼得到粗铜,再经过电解精炼得到纯铜.
由黄铜矿(主要成分是CuFeS2)可以冶炼得到粗铜,再经过电解精炼得到纯铜.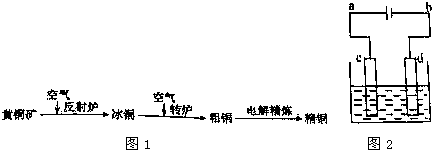

 8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中的Fe的化合价为+2,反应中被还原的元素是______(填元素符号).
8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中的Fe的化合价为+2,反应中被还原的元素是______(填元素符号).