题目内容
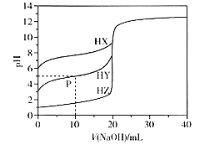
【题目】25℃时,用2a molL﹣1NaOH溶液滴定1.0L2a molL﹣1氢氟酸溶液,得到混合液中HF、F﹣的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
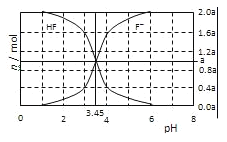
A.pH=3时,溶液中:c(Na+)<c(F﹣)
B.c(F﹣)>c(HF)时,溶液一定呈碱性
C.pH=3.45时,NaOH溶液恰好与HF完全反应
D.pH=4时,溶液中:c(HF)+c(Na+)+ c(H+)-c(OH﹣)<2amolL﹣1
【答案】AD
【解析】
A. pH=3时,c(H+)>c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(F-),则c(F-)>c(Na+),故A正确;
B. 当pH>3.45时,c(F-)>c(HF),溶液可能呈酸性、中性或碱性,故B错误;
C. HF为弱酸,恰好反应时溶液应呈碱性,当pH=3.45时,HF酸过量,故C错误;
D. 溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(F-),c(F-)=c(Na+)+c(H+)-c(OH-),则c(HF)+ c(Na+)+c(H+)-c(OH-)=c(HF)+ c(F-),当pH=4时,混合溶液体积大于1.0L,由物料守恒可知,c(HF)+ c(F-)<2amolL-1,故D正确;
答案选AD。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3, | 溶液呈红色 | 稀HNO3将Fe氧化为 |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |