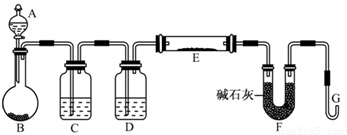
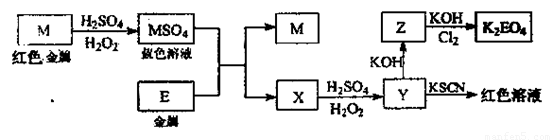
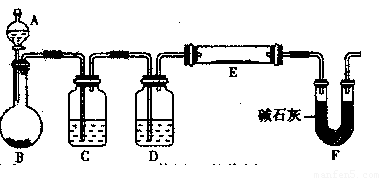
题目内容
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________。
(2)已知
B.Ksp(CaF2)随钙离子和氟离子浓度的增大而增大
C.该体系最终没有沉淀生成
D.该体系最终有沉淀生成
(3)常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(除CO2因逸出而未画)物质的量分数(纵轴)随溶液pH(横轴)变化的情况如下图。

请根据上图所示回答下列问题:
①在同一溶液中,H2CO3、![]() 、
、![]() (填“能”或“不能”) _________________大量共存。
(填“能”或“不能”) _________________大量共存。
②当pH=7时,用一个数学表达式表示溶液中各种离子的物质的量浓度之间的等量关系:_________________。
③已知在![]() (aq)水解反应的平衡常数:
(aq)水解反应的平衡常数:
Kh=![]() =2×10-4 mol·L-1
=2×10-4 mol·L-1
当溶液中c(![]() )∶c(
)∶c(![]() )=2∶1时,溶液的pH=_________________。
)=2∶1时,溶液的pH=_________________。
(1)NO2(g)+CO(g)![]() NO(g)+CO2(g) ΔH=-234 kJ·mol-1
NO(g)+CO2(g) ΔH=-234 kJ·mol-1
(2)C
(3)①不能
②c(Na+)=c(Cl-)+c(![]() )
)
③10
解析:(2)HF的电离平衡常数K为:
K=![]() =3.24×10-9 mol·L-1
=3.24×10-9 mol·L-1
0.2 mol·L-1 HF中c(F-)=![]() mol·L-1=2.55×10-5 mol·L-1
mol·L-1=2.55×10-5 mol·L-1
和CaCl2混合后:Qc=(![]() )2×(
)2×(![]() )=1.62×10-11<Ksp(CaF2)
)=1.62×10-11<Ksp(CaF2)
所以无CaF2沉淀生成
(3)①由图象知H2CO3和![]() 、
、![]() 在pH=8分界线的两侧,所以三者不能大量共存。
在pH=8分界线的两侧,所以三者不能大量共存。
②pH=7时,溶液中不存在![]() ,是NaHCO3、NaCl和H2CO3的混合液,据电荷守恒:
,是NaHCO3、NaCl和H2CO3的混合液,据电荷守恒:
c(Na+)+c(H+)=c(Cl-)+c(![]() )+c(OH-)因为c(H+)+c(OH-),所以c(Na+)=c(
)+c(OH-)因为c(H+)+c(OH-),所以c(Na+)=c(![]() )+c(Cl-)
)+c(Cl-)
③将c(![]() )∶c(
)∶c(![]() )=2∶1代入到Kh表达式中,得c(OH-)=1×10-4 mol·L-1,所以c(H+)=1×10-10 mol·L-1,pH=10。
)=2∶1代入到Kh表达式中,得c(OH-)=1×10-4 mol·L-1,所以c(H+)=1×10-10 mol·L-1,pH=10。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案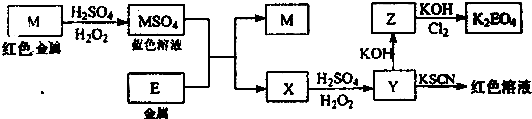
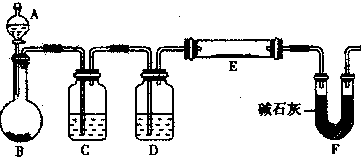

 ,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
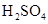 和
和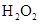 混合液的离子方程式:
。
混合液的离子方程式:
。