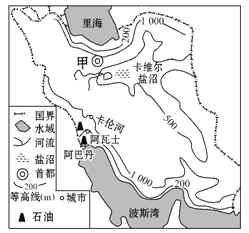
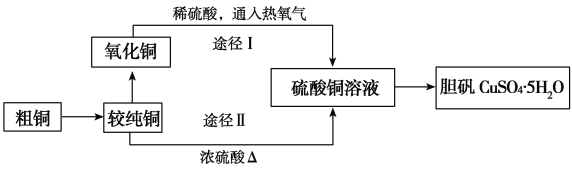
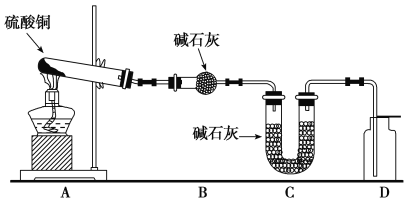
0 79468 79476 79482 79486 79492 79494 79498 79504 79506 79512 79518 79522 79524 79528 79534 79536 79542 79546 79548 79552 79554 79558 79560 79562 79563 79564 79566 79567 79568 79570 79572 79576 79578 79582 79584 79588 79594 79596 79602 79606 79608 79612 79618 79624 79626 79632 79636 79638 79644 79648 79654 79662 109140