题目内容
【题目】硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用。某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量。设计的流程如下:
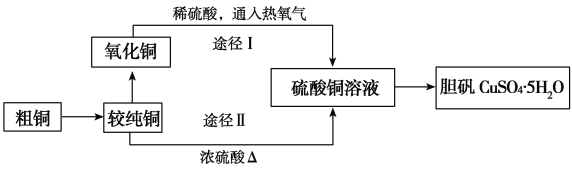
(1)“较纯铜”转化为氧化铜时,应将其置于________内进行灼烧(填写仪器名称)。“粗铜”表面的油脂可以用热碱溶液洗去,原因是______________________。若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜,存在少量铜的可能原因是________。
a.灼烧过程中部分氧化铜被还原
b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜
d.灼烧不充分铜未被完全氧化
(2)通过途径Ⅰ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥。比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点:
①___________________________________。
②___________________________________。
(3)利用下图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量见图下方的表格所示。
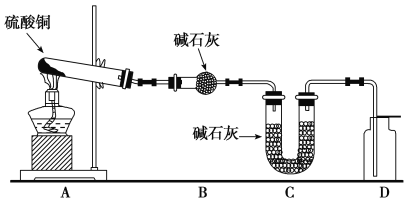
装置 | A(试管+粉末) | B | C |
反应前 | 50.0 g | 70.0 g | 540.0 g |
反应后 | 45.0 g | 74.5 g | 540.0 g |
请通过计算,推断该实验条件下硫酸铜分解的化学方程式:
__________________________________。
【答案】(1)坩埚 油脂在碱性条件下发生水解而除去 ad
(2)蒸发浓缩 过滤洗涤 ①产生等量胆矾,途径Ⅰ消耗硫酸少;②途径Ⅰ不产生污染大气的气体
(3)4CuSO4 =4CuO+2SO3↑+2SO2↑+O2↑
【解析】(1)进行灼烧所需的温度较高应选择坩埚,“粗铜”表面的油脂可以用热碱溶液洗去,原因是油脂在碱性条件下发生水解而除去,若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜。存在少量铜的可能原因是a.灼烧过程中部分氧化铜被还原。d.灼烧不充分铜未被完全氧化。(2)过滤完后还要进行蒸发浓缩然后冷却结晶、过滤洗涤,最后再自然干燥。途径Ⅰ有明显的两个优点:①对照反应转化情况可知产生等量胆矾,途径Ⅰ消耗硫酸少;②途径Ⅰ不产生污染大气的气体。(3)加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃,说明有氧气生成。由记录的数据可得出生成酸性气体质量是4.5 g,生成氧气是0.5 g,根据电子守恒,由生成氧气0.5 g,失电子数![]() ×4。得电子可能是生成了二氧化硫,即生成二氧化硫的量为:
×4。得电子可能是生成了二氧化硫,即生成二氧化硫的量为:![]() ×2,质量为2 g,还有酸性气体应该是三氧化硫,质量为2.5 g,物质的量为2.5/80 mol,即物质的量之比:二氧化硫∶三氧化硫∶氧气=2∶2∶1,根据原子守恒可知生成黑色固体为氧化铜,化学方程式为4CuSO44CuO+2SO3↑+2SO2↑+O2↑。
×2,质量为2 g,还有酸性气体应该是三氧化硫,质量为2.5 g,物质的量为2.5/80 mol,即物质的量之比:二氧化硫∶三氧化硫∶氧气=2∶2∶1,根据原子守恒可知生成黑色固体为氧化铜,化学方程式为4CuSO44CuO+2SO3↑+2SO2↑+O2↑。