题目内容
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
请回答下列问题:
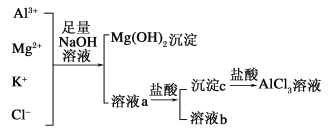
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:____________。
(2)氢氧化钠溶液能否用氨水代替,为什么?_________________。
(3)溶液a中存在的离子有________;在溶液a中加入盐酸时需控制盐酸的量,其原因为_________________。为此,改进方法是_____________________。
【答案】(1)Mg2++2OH-===Mg(OH)2↓ Al3++3OH-===Al(OH)3↓ Al(OH)3+OH-===AlO2-+2H2O
(2)不能,因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开
(3)Cl-、K+、AlO2-、OH-、Na+ 因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀AlO2-时,需要控制盐酸的量,以防止部分AlO2-转化成Al3+ 通入过量二氧化碳气体
【解析】(1)加入足量氢氧化钠溶液,Mg2+可与OH-反应生成Mg(OH)2沉淀,Al3+先与OH-反应生成Al(OH)3,生成的Al(OH)3继续与OH-反应生成NaAlO2和H2O。(2)氢氧化钠溶液不能用氨水代替,因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开。
(3)加入氢氧化钠溶液后除去了Mg2+,但又引入了Na+,同时Al3+转化成了AlO2-;因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀AlO2-时,需要控制溶液的pH,以防止部分AlO2-转化成Al3+;氢氧化铝只能与强碱或强酸反应,因此,可在溶液a中通入过量二氧化碳气体。






