题目内容
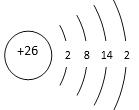
【题目】铁有许多重要的化合物,除中学化学常见的三种氧化物和两种氢氧化物外,还有许多盐。FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。现用绿矾对某工厂废水(含有强氧化性离子![]() )进行处理。
)进行处理。
(1)绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:____________________________。
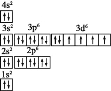
(2)试配平:_______Fe2++_______![]() +_______ ===_______Fe3++_______Cr3++_______H2O
+_______ ===_______Fe3++_______Cr3++_______H2O
(3)若该废水经处理后Cr3+的含量为1×102 mol·m3,理论上83.4 kg绿矾可以处理该废水________吨(已知废水的密度为1 g·cm3)。
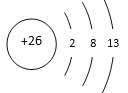
【答案】(1)2FeS2+7O2+2H2O![]() 2FeSO4+2H2SO4
2FeSO4+2H2SO4
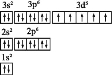
(2)6 1 14 H+ 6 2 7
(3)1×104
【解析】(1)由反应物空气(O2)、水(H2O)、黄铁矿(FeS2)和生成物硫酸亚铁(FeSO4)、常见强酸(可能为H2SO4)可书写化学方程式为2FeS2+7O2+2H2O![]() 2FeSO4+2H2SO4。
2FeSO4+2H2SO4。
(2)根据化合价升降总数相等,确定Fe2+、![]() 的化学计量数分别为6、1,由Fe、Cr原子守恒确定生成物中Fe3+、Cr3+化学计量数分别为6、2,再由电荷守恒,反应物 中补加H+,化学计量数为14,由H原子守恒,生成物H2O的化学计量数为7。
的化学计量数分别为6、1,由Fe、Cr原子守恒确定生成物中Fe3+、Cr3+化学计量数分别为6、2,再由电荷守恒,反应物 中补加H+,化学计量数为14,由H原子守恒,生成物H2O的化学计量数为7。
(3)根据电子守恒,设理论上83.4 kg绿矾可处理该废水x t。
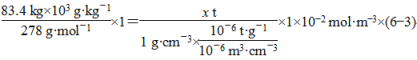
x=1×104。

练习册系列答案
相关题目