(2009?潍坊)下表呈现的是部分元素的原子结构示意图、主要化合价等信息.下列叙述错误的是( )
| 第二周期 | Li | Be | B | C | N | O | F |
| 主要 化合价 | +1 | +2 | +3 | +2,+4,-4 | +2,+5,-3,+4 | -2 | -1 |
| 第三周期 | Na | Mg | Al | Si | P | S | Cl |
| 主要 化合价 | +1 | +2 | +3 | +4,-4 | +3,+5,-3 | +4,+6,-2 | +1,+5,+7,-1 |
23.(2009?潍坊)海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.
I.海水提溴.从海水中提取的溴约占世界溴产量的 ,工业上常用“吹出法”制溴,其工艺流程如下:
,工业上常用“吹出法”制溴,其工艺流程如下:

试回答:
(1)步骤②中的化学方程式为2NaBr+C12=2NaCl+Br2,其反应类型是______,
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:C12+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
由此可判断C12、I2、Br2活动性由强到弱顺序是______.
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
请回答:
(1)碳酸氢铵的化学式是______.
(2)由上表分析过程②中能发生反应的原因是______.
(3)过程③中反应的化学方程式是______ Na2CO3+CO2↑+H2O
I.海水提溴.从海水中提取的溴约占世界溴产量的
 ,工业上常用“吹出法”制溴,其工艺流程如下:
,工业上常用“吹出法”制溴,其工艺流程如下:
试回答:
(1)步骤②中的化学方程式为2NaBr+C12=2NaCl+Br2,其反应类型是______,
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:C12+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
由此可判断C12、I2、Br2活动性由强到弱顺序是______.
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ||
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(1)碳酸氢铵的化学式是______.
(2)由上表分析过程②中能发生反应的原因是______.
(3)过程③中反应的化学方程式是______ Na2CO3+CO2↑+H2O
25.(2009?潍坊)某化学探究小组用HCl与大理石反应研究影响反应剧烈程度的因素.实验温度为25℃、35℃;大理石有细颗粒与粗颗粒两种规格,每次实验取用含碳酸钙60%的大理石10g;所用HCl的质量分数为9.125%、18.25%,每次实验HCl的用量为20mL(假设9.125%、18.25%的盐酸的密度均为1g/em3;大理石中杂质不与盐酸反应).
(1)反应原理:实验中的化学方程式______.
(2)提出假设:HCl与大理石反应的剧烈程度与所用HCl的质量分数、大理石规格、反应温度有关.
(3)实验设计与实施:完成以下实验设计方案并实
(4)实验结论:______.
(5)绘制图象:实验①中CO2质量随时问变化的关系如图,借助简单计算请在右图中画出实验②和③中CO2质量随时间变化关系的曲线(忽略溶液体积变化).
说明:可以用铅笔画曲线.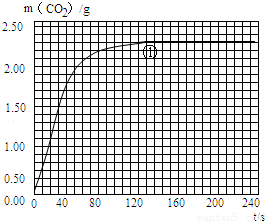
0 94005 94013 94019 94023 94029 94031 94035 94041 94043 94049 94055 94059 94061 94065 94071 94073 94079 94083 94085 94089 94091 94095 94097 94099 94100 94101 94103 94104 94105 94107 94109 94113 94115 94119 94121 94125 94131 94133 94139 94143 94145 94149 94155 94161 94163 94169 94173 94175 94181 94185 94191 94199 211419
(1)反应原理:实验中的化学方程式______.
(2)提出假设:HCl与大理石反应的剧烈程度与所用HCl的质量分数、大理石规格、反应温度有关.
(3)实验设计与实施:完成以下实验设计方案并实
| 实验编号 | T/℃ | 大理石 规格 | HCl的质量分数 | 完全反应的 时间/s | 实验目的 |
| ① | 25 | 粗颗粒 | 18.25% | 160 | (Ⅰ)实验①和②探究同体积下HCl的质量分数对该反应剧烈程度的影响. (Ⅱ)实验①和③探究温度对该反应剧烈程度的影响. (Ⅲ)实验①和④探究大理石规格对该反应剧烈程度的影响. |
| ② | ______ | ______ | ______ | 210 | |
| ③ | 35 | 粗颗粒 | 18.25% | 60 | |
| ④ | ______ | ______ | ______ | 100 |
(5)绘制图象:实验①中CO2质量随时问变化的关系如图,借助简单计算请在右图中画出实验②和③中CO2质量随时间变化关系的曲线(忽略溶液体积变化).
说明:可以用铅笔画曲线.


 表示氯原子,
表示氯原子, 表示氧原子,
表示氧原子, 表示氢原子)
表示氢原子) 2H2O CH4+2O2
2H2O CH4+2O2 2H2O+CO2;
2H2O+CO2;



