26.(2007?佛山)小亮对课本中C和CuO反应的产物进行了进一步的探究,以下是他进行实验的部分流程(装置气密性良好)

(1)通过以上实验,可知产物中有______气体.
(2)取出反应后的固体,观察呈红色.
【查阅资料】①C也能将CuO还原为红色固体Cu2O(氧化亚铜);②Cu2O+H2SO4(稀)=Cu+CuSO4+H2O;
【猜想】
(a)红色固体只是Cu
(b)______
(c)红色固体是Cu和Cu2O的混合物
【实验探究】
交流与反思:从探究中得到的启示或感受是…

(1)通过以上实验,可知产物中有______气体.
(2)取出反应后的固体,观察呈红色.
【查阅资料】①C也能将CuO还原为红色固体Cu2O(氧化亚铜);②Cu2O+H2SO4(稀)=Cu+CuSO4+H2O;
【猜想】
(a)红色固体只是Cu
(b)______
(c)红色固体是Cu和Cu2O的混合物
【实验探究】
| 实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
| 取7.2g红色固体,置于烧杯中,向其中加入足量稀硫酸,充分搅拌,静置. | 若无现象. | 证明红色固体______. |
| 若______ | 证明红色固体肯定含有______,可能含有______. | |
| 取上述反应液过滤、洗涤、干燥和称量,得固体6.8g. | 确认红色固体是______. |
28.(2007?佛山)小忻和小燕合作测定盐酸、硫酸组成的混合酸中溶质的质量分数,设计并进行了如下两个探究实验:
【实验1】取20g该混合酸并分成4等份,然后分别加入一定量未知质量分数的BaCl2溶液,实验记录如下:
【实验2】将【实验1】中的第4份反应液过滤,再向滤液中逐滴加入10%的NaOH溶液,通过pH测定仪打印出加入NaOH溶液的质量与烧杯中溶液pH的关系如图:
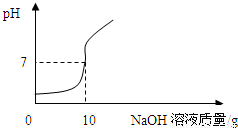
【数据处理】
小忻依据【实验1】沉淀的质量计算出混合酸
中H2SO4的质量分数.
小燕依据【实验2】求混合酸中HCl的质量分数,过程如下:
解:设混合酸中HCl的质量分数为ω.
HCl+NaOH=NaCl+H2O
36.5 40
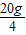 ×ω 10g×10%
×ω 10g×10%
解得:ω=0,1825=18.25%
现请你参与探究并完成相关问题.(可能用到的相对分子质量:H2SO4-98BaSO4-233 BaCl2-208 )
(1)【实验1】中发生反应的化学方程式为______.
(2)小忻测出原混合酸中H2SO4的质量分数为______(保留三位有效数字).
(3)小燕计算出混合酸中HCl的质量分数会______(填“偏高”、“偏低”或“无影响”),理由是______
(如“无影响”,本空不作答).
0 93942 93950 93956 93960 93966 93968 93972 93978 93980 93986 93992 93996 93998 94002 94008 94010 94016 94020 94022 94026 94028 94032 94034 94036 94037 94038 94040 94041 94042 94044 94046 94050 94052 94056 94058 94062 94068 94070 94076 94080 94082 94086 94092 94098 94100 94106 94110 94112 94118 94122 94128 94136 211419
【实验1】取20g该混合酸并分成4等份,然后分别加入一定量未知质量分数的BaCl2溶液,实验记录如下:
| 第1份 | 第2份 | 第3份 | 第4份 | |
| 加入BaCl2 溶液的质量/g | 15 | 20 | 25 | 30 |
| 反应得到的沉淀的质量/g | 1.398 | 1.864 | 2.330 | 2.330 |

【数据处理】
小忻依据【实验1】沉淀的质量计算出混合酸
中H2SO4的质量分数.
小燕依据【实验2】求混合酸中HCl的质量分数,过程如下:
解:设混合酸中HCl的质量分数为ω.
HCl+NaOH=NaCl+H2O
36.5 40
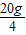 ×ω 10g×10%
×ω 10g×10%解得:ω=0,1825=18.25%
现请你参与探究并完成相关问题.(可能用到的相对分子质量:H2SO4-98BaSO4-233 BaCl2-208 )
(1)【实验1】中发生反应的化学方程式为______.
(2)小忻测出原混合酸中H2SO4的质量分数为______(保留三位有效数字).
(3)小燕计算出混合酸中HCl的质量分数会______(填“偏高”、“偏低”或“无影响”),理由是______
(如“无影响”,本空不作答).


 表示的微粒是( )
表示的微粒是( )